Ołowiowa struktura jodku, właściwości, uzyskiwanie, zastosowania

- 2330
- 194
- Bertrand Zawadzki
On Ołów jodek Jest to związek nieorganiczny utworzony przez pierwiastek ołowiu (Pb) w jego utlenianiu +2 i jod (I) z Walenciją -1. Jego formuła chemiczna to PKB2. Jest to toksyczny związek. Ponieważ prowadzi jest szkodliwe dla ludzi, zwierząt i naturalnych ekosystemów. Ponadto jodek może również powodować niektóre choroby.
Związek PKB4, Wydaje się, że z ołów w utlenianiu +4 wydaje się, że nie istnieje, prawdopodobnie ze względu-). PKB2 Jest to stały żółty kolor, który jest rozpuszczalny w wodzie.
 Ołów jodek (PKB2) solidny. W. Oelen/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons.
Ołów jodek (PKB2) solidny. W. Oelen/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons. Można go uzyskać za pomocą reakcji wymiany jonowej między solą jodku i ołów, które oba są rozpuszczalne w wodzie.
Ma właściwości półprzewodników, więc większość jego obecnych zastosowań znajduje się w urządzeniach fotowoltaicznych, detektorach niektórych promieniowania i czujników.
Jednym z najczęściej badanych zastosowań tego związku są ogniwa słoneczne Perovskita, które okazały się bardzo wydajne i tani koszty.
[TOC]
Struktura
Na wiodącym jodku związek między jego atomami jest jonowy tylko częściowo. Atomy tworzą warstwy ze strukturą sześciokątną i są one powiązane ze sobą przez słabe siły van der Waalsa.
Siły te nie są ani jonowe, ani kowalencyjne, są słabymi interakcjami między elektronicznymi warstwami atomów.
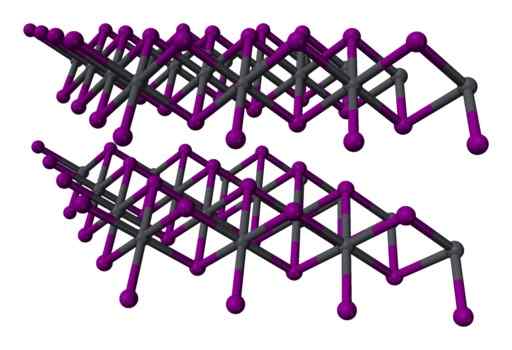 Struktura Trzy -Layer z dwiema warstwą2 krystaliczny. Gray = ołów; Fiolet = jod. Benjah-BMM27 / Public Domena. Źródło: Wikimedia Commons.
Struktura Trzy -Layer z dwiema warstwą2 krystaliczny. Gray = ołów; Fiolet = jod. Benjah-BMM27 / Public Domena. Źródło: Wikimedia Commons. Nomenklatura
- Ołów jodek
- Ołowiany jodek (ii)
- Ołów DIYODURO
- Jodek Plumboso
Nieruchomości
Stan fizyczny
Jasnożółty krystaliczny stał. Sześciokątne kryształy.
 Sześciokątne kryształy ołowiu jodku. Alessandro e Damiano/cc przez (https: // creativeCommons.Org/licencje/według/4.0). Źródło: Wikimedia Commons.
Sześciokątne kryształy ołowiu jodku. Alessandro e Damiano/cc przez (https: // creativeCommons.Org/licencje/według/4.0). Źródło: Wikimedia Commons. Waga molekularna
461 g/mol
Temperatura topnienia
410 ° C
Punkt wrzenia
954 ° C, gotuj z rozkładem.
Gęstość
6,16 g/cm3
Rozpuszczalność
Lekko rozpuszczalna w wodzie: 0,076 g/100 ml w 25 ° C. Gorąca woda rozpuszczalna. Nierozpuszczalny w alkoholu i zimnym kwasie chlorowodorowym (HCL).
Może ci służyć: sód: historia, struktura, właściwości, ryzyko i zastosowaniaWłaściwości chemiczne
Jego właściwości utleniające i redukujące są słabe. Możesz jednak przedstawić reakcje oksydenukcyjne.
Chociaż jest bardzo mało rozpuszczalny w rozpuszczaniu się wody w skoncentrowanych roztworach jodków alkalicznych, takich jak jodek potasu (Ki). Jest rozpuszczalny w stężonym roztworze octanu sodu (CH3Kieszeń). Rozpuszcza się swobodnie w roztworze tiosiarczanu sodu (na2S2ALBO3).
Niektórzy autorzy wskazują, że w wodzie można wygenerować jon PBI+ A jeśli istnieje nadmiar jonów (i-) Można tworzyć bardziej złożone gatunki, takie jak PKB3- i PKB42-, m.in.
To nie jest łatwopalne.
Inne właściwości fizyczne
Zachowuje się jako półprzewodnik, to znaczy, że może, ale nie musi prowadzić energii elektrycznej w zależności od warunków, na które jest poddawany.
Jest to półprzewodnik bezpośredniego szczeliny, to znaczy, że jeden z jego elektronów przechodzi z pasma Valencia do jazdy, musi mieć tylko ilość energii równej zabronionej przepustowości.
Ze względu na wysoką liczbę atomową jego elementów (Pb = 82, i = 53) ma wysoką pojemność fotoelektryczną. Jego pasmo 2,5 w historii pozwala na wydajność fotowoltaiczną o wysokiej wydajności w temperaturach do 250 ° C.
Uzyskanie
Można go przygotować, reagując na rozpuszczalny w wodzie związek kwasem iarhydinowym (HI) lub z rozpuszczalnym metalowym jodkiem. Na przykład mieszany jest wodny roztwór octanu ołowiu z jodkiem potasowym:
PB (rozdz3Gruchać)2 + 2 Ki → PKB2↓ + 2 K (wybierz3Gruchać)
Ten rodzaj reakcji jest znany jako „wymiana jonów”, ponieważ kationów i anionów są wymieniane między solami.
We wspomnianym przykładzie octan potasu jest bardzo rozpuszczalny w wodzie i pozostaje rozpuszczony, podczas gdy jodek potasu, mniej rozpuszczalny, osad i filtr. Oczyszczanie odbywa się poprzez rekrystalizację związku w wodzie.
Może ci służyć: krystalizacjaOpady pbi2 Można to zobaczyć na poniższym obrazie, który pokazuje rurkę testową, w której azotan ołowiu (ii) (Pb (no3)2) i jodek potasu (KI) w roztworze wodnym. Efekt ten nazywa się „Złotem złota”.
 Deszcz złota z PKB2. Stefano SCT/CC BY-S (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons.
Deszcz złota z PKB2. Stefano SCT/CC BY-S (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons. Aplikacje
Jako półprzewodnik
Jest stosowany jako detektor dla fotonów o wysokiej energii, takich jak promieniowanie X i promienie gamma. Może być stosowany w urządzeniach fotowoltaicznych, fotokomórkach, światłach LED, detektorach optycznych oraz w biologicznej klasyfikacji i czujnikach.
W przypadku wprowadzenia do nanostruktur można go zastosować w fotokatalizy i ogniwach słonecznych. Ponadto wiele nanocząstek PKB2 Mają właściwości luminescencyjne.
 Jodek ołowiowy jest używany w detektorach medycznych X -Ray. Autor: LKCJJANG40090. Źródło: Pixabay.
Jodek ołowiowy jest używany w detektorach medycznych X -Ray. Autor: LKCJJANG40090. Źródło: Pixabay. Ogniwa słoneczne
PKB2 Jest to pośrednie w syntezie perowskitów przeznaczonych dla ogniw słonecznych. Ten typ komórek fotowoltaicznych zawiera metyloamonium i jodek ołowiowy (wybierz3NH3PKB3) Na podstawie wuja2.
Takie urządzenia mają wysoką wydajność i niski koszt, więc były to dużo badań i badań.
 Ogniwa słoneczne na dachu domu w terenie. Ogniwa słoneczne, w których stosuje się PBI2 Są bardzo wydajne i nie są bardzo drogie, więc mogą być używane w domach w przyszłości. Autor: Manfred Antranias Zimmer. Źródło: Pixabay.
Ogniwa słoneczne na dachu domu w terenie. Ogniwa słoneczne, w których stosuje się PBI2 Są bardzo wydajne i nie są bardzo drogie, więc mogą być używane w domach w przyszłości. Autor: Manfred Antranias Zimmer. Źródło: Pixabay. Jednak od Cho3NH3PKB3 Może się rozbić z wodą deszczową, badano, w jaki sposób zanieczyszczanie tych komórek może być zarówno, gdy są one używane, jak i po odrzuceniu.
Ch3NH3PKB3 Po kontakcie z wodą pęka na metyloaminę (wybierz3NH2), Kwas jodhydowy i PKB2. Ten ostatni, chociaż jest mało rozpuszczalny w wodzie, z czasem może uwalniać ilości z toksycznego jonu Pb2+.
Badania nie są rozstrzygające, ponieważ miejsce, w którym odbywa się uwalnianie ołowiu, w celu ustalenia, czy kwota może być szkodliwa w krótkim okresie. Z drugiej strony ciągłe uwolnienie może bioakumulacja i będzie bardzo niebezpieczna.
Może ci służyć: Butanone: Struktura, właściwości i zastosowaniaInne aplikacje
- Jest zasiany w postaci sprayu w chmurach, aby produkować deszcz.
- W filtrach astronomii odległej podczerwieni.
- W fotografii wrażenia, filmy do nagrywania obrazów optycznych, emulsje fotograficzne.
- W powładzie hamulcowej. W smarowaniu tłuszczów.
- Lampy parowe rtęciowe. Na papierze elektrotycznym.
- Materiały termoelektryczne, baterie termiczne z jodem.
Ryzyko
Dla ochrony
Musi być przechowywany z daleka od utleniaczy, takich jak nadtlenki, nadtlenki, permanganany, chloriny i azotany. Należy również unikać kontaktu z chemicznie aktywnymi metaliami, takimi jak potas, sód, magnez i cynk. We wszystkich tych przypadkach może wystąpić gwałtowna reakcja.
Jeśli poddasz się ogrzewaniu, wytwarzane są trujące gazy ołowiu i jodu.
Do zdrowia
Jest bardzo szkodliwy dla człowieka. Potwierdzono, że jest to czynnik rakotwórczy dla zwierząt, dlatego rozsądnie wywnioskowano, że dotyczy on również istoty ludzkiej.
Może powodować ból głowy, drażliwość, zmniejszyć pamięć i przeszkadzać snu. Ołów zawarty w tym związku może generować trwałe uszkodzenie nerek, mózgu, nerwów, krwinek i ryzyka wysokiego ciśnienia.
Musi być traktowany jako teratogen (związek, który może wygenerować wadę wrodzoną). Może również wytwarzać jodzm, którego objawy są przekrwienie nozdrzy, ból głowy, podrażnienie błon śluzowych i erupcja skórna, między innymi.
Dla środowiska naturalnego
Jest klasyfikowany jako toksyczny zanieczyszczenie. Należy go trzymać z dala od wody i opróżniać źródła. Aby uniknąć zanieczyszczenia wałów, należy zbudować, gdy konieczne jest ją zachowanie.
Jest to bardzo toksyczne wobec życia wodnego z efektami, które trwają z czasem, ponieważ można je bioakumulacja.
Bibliografia
- Ołów, d.R. (redaktor) (2003). Podręcznik chemii i fizyki CRC. 85th CRC Press.
- LUB.S. National Library of Medicine. (2019). Ołów jodek. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Evstropiev; S.K. i in. (2020). Synteza i charakterystyka PVP/PBI2. Adv Compos Hybrid Mater 3, 49-57 (2020). Link odzyskał.Skoczek.com.
- Ismail, r.DO. i in. (2016). Synteza PBI2 Nanocząsteczki przez ablację laserową w metanolu. J Mater Sci: Mater Electron 27, 10696-10700 (2016). Link odzyskał.Skoczek.com.
- MATERIAŁY. (2013). Ołów jodek (PKB2) Półprzewodnik. Wyzdrowiał z Azomu.com.
- CDH (2008). Ołów (ii) jodek. Materiał z arkusza danych bezpieczeństwa. Odzyskane z chdfinechemical.com.
- Hailegnaw, ur. i in. (2015). Deszcz na perowskitych jodku ołowiu metyloamonium: możliwe działanie środowiskowe ogniw słonecznych perowskitu. J. Phys. Chem. Łotysz. 2015, 6, 9, 1543-1547. Odzyskane z pubów.ACS.org.
- Fundacja Wikimedia (2020). Ołów (ii) jodek. Odzyskane z.Wikipedia.org.
- « Ołowiowa struktura octanu, właściwości, uzyskiwanie, zastosowania
- Organizacja obiektywnej firmy, struktura, przykład »

