Ołowiowa struktura octanu, właściwości, uzyskiwanie, zastosowania

- 1661
- 244
- Pani Waleria Marek
On Ołowiak ołowiowy o Octan ołowiu (II) jest związkiem utworzonym przez jon ołowiu (Pb2+) i dwa jony octanu (ch3Gruchać-). Jego formuła chemiczna jest (Cho3Gruchać)2PB lub PB (wybierz3Gruchać)2.
Jest również znany jako „ołowiowy cukier” z powodu słodkiego smaku. Jest to jednak bardzo trująca substancja. Jest to bardzo rozpuszczalna krystaliczna substancja stała w wodzie. Możesz łatwo reakcja z siarkowodorem (h2S) Generowanie brązowego siarczku ołowiu (PBS), który jest stosowany w wykrywaniu tego toksycznego gazu w procesach przemysłowych.
 Ołów stały (ii) ołowiu. DormoothEmist w English Wikipedia/CC przez (https: // creativeCommons.Org/licencje/według/3.0). Źródło: Wikimedia Commons.
Ołów stały (ii) ołowiu. DormoothEmist w English Wikipedia/CC przez (https: // creativeCommons.Org/licencje/według/3.0). Źródło: Wikimedia Commons. W czasach starożytnych uzyskano go z względną łatwością, więc miało zastosowanie, które są obecnie całkowicie zabronione z powodu toksyczności tego związku.
Ołowiowy proszek octanu nie powinien być rozproszony w środowisku, ponieważ tworzy wybuchowe mieszaniny z tlenem. Ponadto jest to związek rakotwórczy dla zwierząt i ludzi.
Jest wchłaniany w tkankach organicznych łatwiej niż inne związki ołowiowe. Ma tendencję do bioakumulacji w żywych istotach, więc nie należy go odrzucić do środowiska.
[TOC]
Struktura
Octan ołowiu (II) ma strukturę pokazaną na poniższym rysunku:
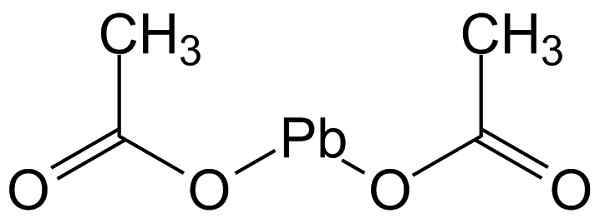 Struktura molekularna octanu ołowiu (II). Michał Sobkowski/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons.
Struktura molekularna octanu ołowiu (II). Michał Sobkowski/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons. Nomenklatura
- Octan ołowiu (ii)
- Diacetan ołowiu
- Ołów etanoate
- Octan Plumboso
- Ołowiany cukier
- Sól Saturn
Nieruchomości
Stan fizyczny
Krystaliczne stałe bezbarwne do białego.
Waga molekularna
325 g/mol
Temperatura topnienia
280 ° C
Punkt wrzenia
Nie gotuj. Załamuje się, gdy jest podgrzewany.
Gęstość
3,25 g/cm3
Rozpuszczalność
Bardzo rozpuszczalny w wodzie: 44,3 g/100 ml w 20 ° C. Nierozpuszczalny w alkoholu.
Ph
Roztwór wodny do 5% ma pH 5,5-6,5.
Właściwości chemiczne
Kiedy PB (OCOCH3)2 Rozpuszcza się w wodzie część jest jonizowana w następujący sposób:
PB (OCOCH3)2 → Pb2+ + 2 Ch3Gruchać-
Jednak część cząsteczek nie jest zjonizowana i pozostaje w postaci:
Ch3COO-PB-COCH3.
Kiedy jon PB2+ Wprowadź roztwór częściowo hydrolizy w wodzie wytwarzającej gatunki PB4(OH)44+.
Wodne roztwory octanu Pb (II) rozpuszczają tlenek ołowiu (PBO).
Może ci służyć: ButenoReaguje z siarkowodorem (h2S) w celu utworzenia brązowego ołowiu siarczku ołowiowego (PBS).
PB (OCOCH3)2 + H2S → PBS + 2 CH3Cooh
Jeśli dodaje się wodny roztwór amoniaku (NH3) Białe osad lub biały octan podstawowego octanu powstaje na przewodzie octanu ołowiu.
Inne właściwości
Emituje zapach podobny do octu. Ma słodki smak. Jego najczęstszą formą komercyjną jest PB Trihydrate (CH3Gruchać)2 •3H2ALBO.
 Ołowiu trójstron octanu. Leiem/cc by-sa (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons.
Ołowiu trójstron octanu. Leiem/cc by-sa (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons. Uzyskanie
Można go przygotować przez rozpuszczenie tlenku lub węglanu ołowiu (II) w skoncentrowanym kwasie octowym. Można również zastosować małe cienkie metaliczne płyty ołowiowe.
PBO + 2 CH3COOH → (CH3Gruchać)2PB + H2ALBO
Starożytne zastosowania
W medycynie
Zastosowano go w rozcieńczonym roztworze, aby zastosować go jako okład i przemyty w zapaleniach spowodowanych trującym bluszczeniem i jako ściągający w balsamach. Także leczenie biegunki.
W zabiegach weterynaryjnych
Został zastosowany jako ściągający i uspokajający balsam w leczeniu powierzchownych stanów zapalnych i siniaków.
W kosmetykach
Został wyprodukowany w czasach starożytnych rzymskich. Niektóre kobiety zastosowały go do twarzy, aby wyglądać blady, co było nie tylko modą, ale także kwestią statusu społecznego.
Biała cera wskazała, że kobieta nie należała do klasy robotniczej, ale do najwyższego poziomu społeczeństwa rzymskiego. I stało się to pomimo faktu, że ówczesne lekarze, tacy jak Plino El Viejo, znali niektóre z jego szkodliwych skutków.
Jako słodzik napojów
Ze względu na słodki smak był stosowany w starożytności jako substytut cukru, szczególnie w winie i osłodzeniu i oszczędzaniu owoców.
W kilku aplikacjach
Niektóre z tych zastosowań nadal mają zastosowanie, ale konsultowana literatura nie ma jasności:
- W chromowanych pigmentach, jako element barwników klejących, w suchych mydłach organicznych do obrazów, lakierów i atramentów, takich jak repelent wodny, w farbach przeciwbólowych.
- W trakcie uzyskiwania złota przez cyjanki, w celu pokrycia metali ołowiu.
- Jako mordanty w barwnika bawełnianym, składnik mocowania wanny do drukowania papieru słonecznego.
- Leczyć markizy i meble ogrodowe, a tym samym zapobiegać usuwaniu środków chroniących przed pogorszeniem pleśni i deszczu.
Bieżące zastosowania
W wykryciu H2S
W niektórych procesach przemysłowych jest wykorzystywany do wykrywania toksycznego h2S w prądach gazowych poprzez rolę próbną, w której służy jako wskaźnik. Limit wykrywania wynosi 5 ppm (części na milion).
 Octan ołowiu (ii) pozwala wykryć h2S w gazach przemysłowych, aby ten toksyczny gaz nie został uwalniany do atmosfery. Autor: Leestilltaolcom. Źródło: Pixabay.
Octan ołowiu (ii) pozwala wykryć h2S w gazach przemysłowych, aby ten toksyczny gaz nie został uwalniany do atmosfery. Autor: Leestilltaolcom. Źródło: Pixabay. W ostatnich testach nanofibras zostały włączone wraz z polimerem, co powoduje nowy materiał wykrywający, który umożliwia obecność 400 ppb (części na miliard) H2S nawet wilgoć 90%.
Wysoki potencjał tego nanomateriału jako czujnika kolorymetryczny sprawia, że ma zastosowanie do wykrywania H2S w tchu ludzi cierpiących na cuchnących, których zasięg jest poniżej 1 ppm.
 Nowe nanowłókna zawierające PB (CH3Gruchać)2 Mogą wykryć bardzo małe ilości h2S w oddechu. Autor: Natalia Ovcharenko. Źródło: Pixabay.
Nowe nanowłókna zawierające PB (CH3Gruchać)2 Mogą wykryć bardzo małe ilości h2S w oddechu. Autor: Natalia Ovcharenko. Źródło: Pixabay. W uzyskiwaniu innych związków
Pozwala przygotować inne związki ołowiowe, takie jak węglan i chromian, sole ołowiowe o wysokiej masie cząsteczkowej i przeciwutleniacze kwasów tłuszczowych do gumy.
Do użytku zewnętrznego
Zgodnie z niektórymi źródłami, ten związek jest nadal stosowany w barwnikach do włosów, których wskazania zastosowania ostrzegają, że nie należy go stosować w innych częściach ciała inaczej niż skóra głowy.
Jest także częścią zewnętrznego użytku produktów przeciwbólowych i ochraniaczy skóry.
Jednak w obu przypadkach nie ma wystarczających dowodów na ustalenie stopnia bezpieczeństwa tych produktów, więc w krajach takich jak Kanada i w stanie USA w Kaliforni.
Ryzyko
Dla ochrony
Nie jest to paliwo, ale jest rozproszone w środowisku w postaci drobnych cząstek może generować wybuchowe mieszanki z powietrzem.
Powinien być przechowywany daleko od utleniania związków, silnych kwasów i chemicznie aktywnych metali oraz w obszarach bez drenażu lub dostępu do kanalizacji prowadzących do ścieków.
Do zdrowia
Może podrażniać oczy, dróg oddechowy i trawienie, powodując ból głowy, nudności, wymioty, kolkę, osłabienie mięśni, skurcze, napady, porażenie, zawroty głowy, utrata przytomności, śpiączka, a nawet śmierć.
Może ci służyć: kwas hiposulfurowyOctan ołowiu jest pochłaniany około 1,5 razy szybciej niż inne związki ołowiu.
 Ołowiak negatywnie wpływa na mózg dzieci. Autor: Pete Lyforth. Źródło: Pixabay.
Ołowiak negatywnie wpływa na mózg dzieci. Autor: Pete Lyforth. Źródło: Pixabay. Bardzo niskie stężenie krwi u dzieci może powodować nadpobudliwość lub niepełnosprawność neurondukowną, ponieważ generuje wpływ na układ nerwowy. Może również powodować anemię i uszkodzenie nerek.
W przypadku zwierząt wystarczająco udowodniono, że rozmnażanie się, rakotwórcze i teratogenne jest toksyczne. Szacuje się, że istoty ludzkie wpływają w ten sam sposób.
Dla środowiska
Jest uważany za niebezpieczną substancję dla środowiska, ponieważ jest to toksyczne zanieczyszczenie. Jest bardzo szkodliwy dla organizmów wodnych. Szczególną uwagę należy zwrócić na ptaki, ssaki, zanieczyszczenie gleby i jakość wody.
Może wystąpić bioakumulacja tego związku w roślinach i zwierzętach. Międzynarodowe instytucje ekologiczne zdecydowanie nie pozwalają wejść do środowiska, ponieważ jest ono trwałe.
Historyczne zatrucie
Jednym z badanych wydarzeń było prezydenta Stanów Zjednoczonych Andrew Jacksona (1767–1845), które przeszło zabieg „ołowiu”, który w tym czasie był tradycyjnym środkiem zaradczym z różnorodnymi celami.
W 1999 r. Podjęto środki do dwóch próbek włosów uzyskanych w życiu prezydenta i stwierdzono, że poziomy ołowiu były bardzo wysokie w obu próbkach, co jest kompatybilne z objawami cierpiących hydraulizm.
 Andrew Jackson był odurzony przez leki oparte na ołowie. Autor: Gordon Johnson. Źródło: Pixabay.
Andrew Jackson był odurzony przez leki oparte na ołowie. Autor: Gordon Johnson. Źródło: Pixabay. Zarówno ich litery, jak i biograf opisują, że przedstawił objawy, takie jak nudności, skurcze brzucha i paralityczny reumatyzm, między innymi. Ale po pewnym czasie Jackson porzucił leczenie octanu ołowiu, więc jego zdrowie się poprawiło.
Dlatego szacuje się, że jego śmierć prawdopodobnie nie była spowodowana zatruciem ołowiem.
Bibliografia
- LUB.S. National Library of Medicine. (2019). Ołów (ii) octan. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Ołów, d.R. (redaktor) (2003). Podręcznik chemii i fizyki CRC. 85th CRC Press.
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Ghazi, a.M. i Millette, J.R. (1964). Ołów. Ołowiak ołowiowy. W kryminalistycznym środowisku. Odzyskane z naukowym.com.
- Mushak, str. (2011). Lead i zdrowie publiczne. W metalach śladowych i zanieczyszczeniach oher w zazdrości. Odzyskane z naukowym.com.
- Cha, J.-H. i in. (2018). Podparts na milion kolorymetryczny czujnik siarkowodoru: nanowłókna ołowiu w kierunku diagnozy halitozy. Anal Chem 2018 7 sierpnia; 90 (15): 8769-8775. NCBI odzyskało.NLM.Nih.Gov.
- Fundacja Wikimedia (2020). Ołów (ii) octan. Odzyskane z.Wikipedia.org.
- Stewart, s. (2015). „Lśniący i śmiertelnie biały”. Uczciwa cera. W historii toksykologii i zdrowia środowiska. Odzyskane z naukowym.com.
- Deppisch, L.M. i in. (1999). Ekspozycja Andrew Jacksona na Merkury i Lead: Zatruty prezydent? JAMA 1999 11 sierpnia; 282 (6): 569-71. NCBI odzyskało.NLM.Nih.Gov.
- « Struktura azotanu ołowiu, właściwości, uzyskiwanie, użycia
- Ołowiowa struktura jodku, właściwości, uzyskiwanie, zastosowania »

