Struktura azotanu ołowiu, właściwości, uzyskiwanie, użycia

- 4429
- 375
- Marianna Czarnecki
On azotan ołowiowy o Azotan ołowiu (II) jest związkiem nieorganicznym utworzonym przez pierwiastki ołowiowe (PB), azot (N) i tlen (O). Ołów znajduje się jako jon pb2+ A azot i tlen tworzą jon azotanu3-.
Jego formuła chemiczna to PB (nie3)2. Jest to biała krystaliczna stała, bardzo rozpuszczalna w wodzie, gdzie tworzy jony PB2+ i nie3-. Jest również znany jako azotan hydrauliczny, ponieważ ołów jest w najniższym stanie utleniania.
 Solidny azotan ołowiu. Domena Ondřej Mang / pub. Źródło: Wikimedia Commons.
Solidny azotan ołowiu. Domena Ondřej Mang / pub. Źródło: Wikimedia Commons. Ma silnie utleniające właściwości, więc jest stosowany w zastosowaniach, w których wymagana jest ta cecha, na przykład w przygotowaniu różnych związków organicznych i jako odczynnik laboratoryjny.
W przeszłości był szeroko stosowany do przygotowywania kolorów opartych na ołowie, gdzie działał również jako utrwalacz kolorów w tkankach. Ta aplikacja została porzucona z powodu prowadzenia toksyczności.
Był używany w branży metalurgicznej na różne sposoby, a ostatnio stwierdzono, że jego przydatność tworzy się, wraz z innymi związkami, materiałami o wysokich zdolnościach wchłaniania światła i transformacji tego w energii elektrycznej.
Jest to jednak niebezpieczna substancja, ponieważ może sprzyjać pokoleniu ognia. Jest to również toksyczne dla ludzi, zwierząt i roślin, więc nigdy nie należy go odrzucić w środowisku.
[TOC]
Struktura
Jest to związek jonowy utworzony przez kation PB2+ i dwa aniony nie3-. W azotanowym tlenu anionu są ułożone symetrycznie wokół azotu i naprzemiennie podwójne wiązanie z tym.
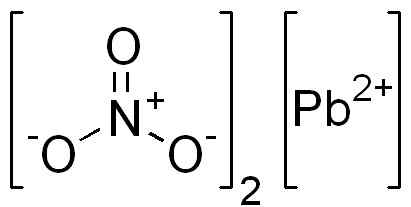 Struktura PB (nie3)2. Domena EDGAR181 / PUB. Źródło: Wikimedia Commons.
Struktura PB (nie3)2. Domena EDGAR181 / PUB. Źródło: Wikimedia Commons. 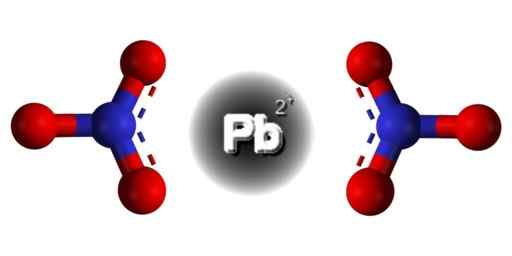 Struktura przestrzenna Pb (nie3)2. Gray = ołów; niebieski = azot; Czerwony = tlen. Claudio Pistilli/CC BY-S (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons.
Struktura przestrzenna Pb (nie3)2. Gray = ołów; niebieski = azot; Czerwony = tlen. Claudio Pistilli/CC BY-S (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons. Ołów w tym związku ma następującą konfigurację elektroniczną:
[Xe] 4F14 5D10 6S2 6P0, gdzie obserwuje się, że stracił 2 elektrony ostatniej warstwy.
Może ci służyć: jaki jest najbardziej elektroonywentowy element i dlaczego?Nomenklatura
- Azotan ołowiowy
- Azotan ołowiu (ii)
- Azotan Plumboso
- Prowadzić dinytrate
Nieruchomości
Stan fizyczny
Biały lub bezbarwny krystaliczny stał. Kryształy sześcienne.
Waga molekularna
331 g/mol
Temperatura topnienia
470 ° C. Według niektórych źródeł rozkłada się w tej temperaturze.
Gęstość
4,53 g/cm3
Rozpuszczalność
Bardzo rozpuszczalny w wodzie: 59,7 g/100 ml wody w 25 ° C. Lekko rozpuszczalne w etanolu. Nierozpuszczalny w kwasie azotowym (HNO3) skoncentrowany.
Ph
Wodny roztwór z 20% PB (NO3)2 Ma pH 3,0-4,0.
Właściwości chemiczne
Jest środkiem utleniającym. Reaguje gwałtownie z palnymi materiałami i redukcjami.
To nie jest paliwo, ale może przyspieszyć spalanie materiałów. Jeśli ogrzewasz się do jego rozkładu, emituje toksyczne gazy tlenku azotu:
2 PB (nie3)2 + ciepło → 2 PBO + 4 NO2↑ + o2↑
Podczas rozpuszczania się w wodzie jest jonizowana:
PB (nie3)2 + H2O → Pb2+ + 2 nie3-
Uzyskanie
Można go przygotować przez reakcję ołowiu metalicznego, tlenku ołowiu (PBO) lub węglanu ołowiu3 Z kwasem azotowym. Wygodne jest stosowanie nadmiaru kwasu, aby zapobiec podstawowym azotanom.
PBO + 2 HNO3 (skoncentrowane) → Pb (NO3)2↓+ h2ALBO
Aplikacje
W organicznych
Jego zdolność utleniania ma zastosowanie w przygotowaniu różnych związków.
Został użyty do syntezy kalixarenos, które są związkami organicznymi, których cząsteczka ma kształt kosza, który pozwala pomieścić inne substancje w zależności od zastosowania, które zostanie podane.
Służy do uzyskania izotiociananów (R-CS), zaczynając od amin (R-NH2).
Jest stosowany w skali przemysłowej do przygotowania benzaldehydu utleniającego chlorek benchilo. Służy również jako katalizator estryfikacji związków organicznych, na przykład w uzyskiwaniu poliesterów.
W analizie chemicznej
Jest stosowany jako odczynnik w określeniu aluminium i ołowiu w minerałach i skałach.
W zabarwieniu włókien tekstylnych
Niektóre barwniki chromowe wymagają użycia PB (nie3)2 pozyskać. Na przykład, aby farbować bawełniany żółty, jest pokryty azotanem ołowiowym i jest traktowany siarczanem sodu w celu wytworzenia siarczanu ołowiu.
Może ci służyć: równoważna wagaNastępnie stosuje się rozcieńczony roztwór dichromianu sodu w celu utworzenia chromianu ołowiu (PBCRO4) To jest żółty pigment.
 Pewnie żółte tkaniny były zabarwione pigmentami, których punktem wyjścia było PB (nie3)2. Nie odbywa się to przez toksyczność ołowiu. Autor: 3D Animation Production Company. Źródło: Pixabay.
Pewnie żółte tkaniny były zabarwione pigmentami, których punktem wyjścia było PB (nie3)2. Nie odbywa się to przez toksyczność ołowiu. Autor: 3D Animation Production Company. Źródło: Pixabay. Jednak dziś wiodące pigmenty ich toksyczności zostały zatrzymane.
Działa również jako mordowanie do naprawy barwników podczas koloru lub drukowania innych rodzajów włókien.
W Medina weterynaryjnym
Wcześniej był stosowany jako środek żrący w leczeniu kancrosów lub gangrenach u koni.
W branży metali
Azotan ołowiu jest stosowany w elektrolitycznej rafinacji ołowiu, jako środek sprzyjający flotacji w usuwaniu tytanu niektórych glin, pozwala odzyskać metale szlachetne roztworów cyjanku i jest stosowany w elektrodie PBO2 na niklu Anodes.
W ogniwach słonecznych
Został zastosowany w postaci roztworu wodnego do wytwarzania ogniw słonecznych opartych na perowskicie, minerałach tlenku tytanu.
Zsyntetyzowany materiał jest organometalicznym lub pervskita jodku ołowiowego, który zwrócił uwagę naukowców, ponieważ ma wysoką zdolność absorpcji światła i dużą długość dyfuzji nośników obciążenia.
Te cechy sprawiają, że jest to doskonały kandydat na urządzenia fotowoltaiczne, to znaczy zamieniają światło w prąd elektryczny.
 Mikrofotografia struktury unawskita halogenku ołowiu pobrana za pomocą mikroskopu fluorescencyjnego. Furava/cc przez (https: // creativeCommons.Org/licencje/według/4.0). Źródło: Wikimedia Commons.
Mikrofotografia struktury unawskita halogenku ołowiu pobrana za pomocą mikroskopu fluorescencyjnego. Furava/cc przez (https: // creativeCommons.Org/licencje/według/4.0). Źródło: Wikimedia Commons. Inne aplikacje
On (pbno3)2 Został również użyty:
- W produkcji meczów niektóre materiały wybuchowe i materiały pirotechniczne,
- W fotografii jako środek uwrażliwiający się na pokrycie artykułu w fototermografii,
- W przemyśle tekstylnym w celu ulepszenia Rayona i stabilizacji nylonu,
- W eliminacji gryzoni.
 Azotan ołowiu został wykorzystany do produkcji fajerwerków lub materiału pirotechnicznego. Autor: Free-Goos. Źródło: Pixabay.
Azotan ołowiu został wykorzystany do produkcji fajerwerków lub materiału pirotechnicznego. Autor: Free-Goos. Źródło: Pixabay. Ryzyko
Ogień i eksplozja
Chociaż nie jest to związek paliwa, jeśli jest narażony na pożar lub ciepło, może eksplodować, wytwarzanie toksycznych tlenków azotu.
Będąc silnie utleniającym środkiem istnieje niebezpieczeństwo, że pożar jest generowany, jeśli ma kontakt z materiałami organicznymi.
Do zdrowia
Powoduje podrażnienie oka, dróg oddechowych i trawiennych. Jest toksyczny przez wdychanie i spożycie. Najczęstszymi objawami zatrucia przez ten związek są żołądkowo -jelit, kolka, zaparcia i osłabienie, które mogą stać się porażeniem niektórych mięśni, między innymi.
Jego spożycie może również powodować ból, skurcze, depresję, śpiączkę i śmierć.
Dla środowiska naturalnego
Jest to toksyczne dla organizmów wodnych i lądowych, a także ich szkody są trwałe, a bioakumula w żywych istotach, dlatego jest uważany za niebezpieczny zanieczyszczenie i nie należy go odrzucić na środowisko.
Jeśli przez przypadek rozlany jest w wodzie, należy go zneutralizować za pomocą tlenku wapnia (CAO), węglanem wapnia (CACO3) lub wodorowęglan sodu (Nahco3).
Potwierdzono, że jest to czynnik rakotwórczy dla zwierząt i prawdopodobnie dla człowieka.
Bibliografia
- LUB.S. National Library of Medicine. (2019). Ołów (ii) azotan. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Hsih, t.I. i in. (2015). Efektywne ogniwo słoneczne posvskite wytwarzane przy użyciu wodnego prekursora azotanu ołowiu. Chem Commun (zmiana). 2015 września 4; 51 (68): 13294-7. NCBI odzyskało.NLM.Nih.Gov.
- Vratny, f. i gugliotta, f. (1963). Rozkład tematyczny azotanu ołowiu. J. Inorg. Nucl. Chem., 1963, t. 25, pp. 1129-1132. Odzyskane z naukowym.com.
- Chakraborty, J.N. (2014). Farbowanie kolorami minerałów. W funduszach i praktykach w zabarwianiu tekstyliów. Odzyskane z naukowym.com.
- Kumari, h. i Atwood, J. (2017). Calixarenes w stanie stałym. W odniesieniu do chemii, nauk molekularnych i inżynierii chemicznej. Odzyskane z naukowym.com.
- Jeffery, s. 1.G. i Hutchison, D. (1981). Aluminium. W metodach chemicznych analizy skalnej (wydanie trzecie). Odzyskane z naukowym.com
- Sandler, s.R. i Karo, w. (1992). Inyany, izocyjaniany, tiocyjaniany i izotiocyjaniany. W książce źródłowej zaawansowanych organicznych preparatów laboratoryjnych. Odzyskane z naukowym.com.
- Smith, s.W.G. i in. (1969). Aromatyczne związki halogenowe. W chemii aromatycznej. Odzyskane z naukowym.com.
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Ołów, d.R. (redaktor) (2003). Podręcznik chemii i fizyki CRC. 85th CRC Press.
- Fundacja Wikimedia (2020). Ołów (ii) azotan. Odzyskane z.Wikipedia.org.
- Shinde, d.V. i in. (2017). Zwiększone potrząsanie i stabilność wodno-ołowiowej azotanu omitrate organometalliczne komórek słonecznych perowskitowych. ACS Appl. Mater. Interfejsy 2017, 9, 14023-14030. Odzyskane z pubów.ACS.org.
- « Właściwości fenoli lub związków fenolowych, typy, zastosowania
- Ołowiowa struktura octanu, właściwości, uzyskiwanie, zastosowania »

