Chimotrypsyna charakterystyka, struktura, funkcje, mechanizm działania
- 3062
- 319
- Pani Waleria Marek
Chimotripsin Jest to drugie najliczniejsze białko trawienne przez trzustkę w kierunku jelita cienkiego. Jest to enzym należący do rodziny proteas seryny i specjalizuje się w hydrolizy wiązań peptydowych między aminokwasami, takimi jak tyrozyna, fenyloalanina, tryptofan, metoda i leukina obecne w dużym białku.
Nazwa „chemotrypsyna” łączy się, w rzeczywistości grupa enzymów wytwarzanych przez trzustkę i które aktywnie uczestniczą w trawieniu jelitowych białek u zwierząt. Słowo pochodzi od działania reninowego, które ten enzym ma na temat treści żołądka lub „chimo”.
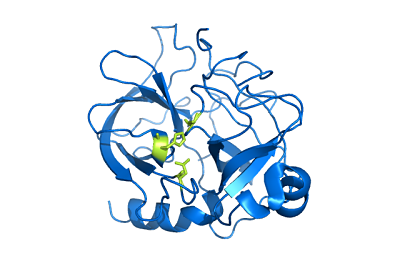
 Struktura chimotrypsyny (źródło: Użytkownik: Mattyjenjen [atrybucja] przez Wikimedia Commons)
Struktura chimotrypsyny (źródło: Użytkownik: Mattyjenjen [atrybucja] przez Wikimedia Commons) Chociaż nie wiadomo dokładnie, jak szeroki jest jego dystrybucja w królestwie zwierząt, uważa się, że enzymy te są obecne przynajmniej we wszystkich jagnięciach i istnieją doniesienia o ich obecności w „bardziej prymitywnych krawędzi”, takich jak stawonogów i oddział Celestroads.
U tych zwierząt, które mają trzustkę, taki narząd jest głównym miejscem produkcji chimotrypsyny, a także innych proteaz, inhibitorów enzymatycznych i prekursorów lub Zimogen.
Chimotrypsyny są najczęściej badanymi i lepiej scharakteryzowanymi enzymami, nie tylko w odniesieniu do ich biosyntezy, ale także z ich aktywacją z Zimogenu, jego właściwości enzymatycznych, jego zahamowanie, jego cechy kinetyczne i katalityczne oraz ogólną strukturę struktury.
[TOC]
Charakterystyka i struktura
Chimotrypsyny są endopeptydazami, to znaczy są proteazami, które hydrolizują wiązania peptydowe aminokwasów w „wewnętrznych” pozycjach innych białek; Chociaż wykazano również, że mogą hydrolizować estry, Amidas i Arilamidas, chociaż z mniejszą selektywnością.
Mają średnią masę cząsteczkową około 25 kDa (245 aminokwasów) i są wytwarzane z prekursorów znanych jako chemotrypsinogens.
Z trzustki zwierząt bydlęcych oczyszczono 2 rodzaje chemotrypsinogenów. W modelu PIG A Trzeci chemotrypsynogen, opisano chimotrypsynogen C. Każdy z tych trzech Zimogenów jest odpowiedzialny za produkcję odpowiednio chimotropsyn A, B i C.
Może ci służyć: Quintana Roo Flora i FaunaChimotrypsyna A jest tworzona przez trzy łańcuchy polipeptydowe, które są kowalencyjnie ze sobą połączone przez mosty lub wiązania disiarczkowe między resztami cysteiny. Należy jednak wspomnieć, że wielu autorów uważa to za monomeryczny enzym (złożony z pojedynczej podjednostki).
Łańcuchy te stanowią strukturę o kształcie elipsoidów, w której grupy mające obciążenia elektromagnetyczne znajdują się w kierunku powierzchni (z wyjątkiem aminokwasów, które uczestniczą w funkcjach katalitycznych).
Zasadniczo chimotropsyny są niezwykle aktywne na pH kwasu, chociaż te, które zostały opisane i oczyszczone z owadów i innych zwierząt niekręgowych, są stabilne przy pH między 8 a 11 i wyjątkowo niestabilne do obniżenia pH.
Funkcje chemotrypsyny
Gdy stymulowana jest trzustka zewnątrzwydzielnicza, czy to przez hormony, czy przez impulsy elektryczne, narząd ten uwalnia granulki wydzielnicze bogate w chemotrypsynogen, które kiedyś dociera do jelita cienkiego, jest cięta przez inną proteazę między odpadami 15 i 16 Całkowicie aktywne białko.
Być może główną funkcją tego enzymu jest działanie w porozumieniu z innymi wydalanymi proteazami w kierunku układu przewodu pokarmowego w celu trawienia lub degradacji białek spożywanych z żywnością.
Produkty takiej proteolizy służą następnie jako źródło węgla i energii poprzez katabolizm aminokwasowy lub mogą być „poddane recyklingowi” bezpośrednio dla tworzenia nowych białek komórkowych, które będą wykonywać wiele i różnorodne funkcje na poziomie fizjologicznym.
Mechanizm akcji
Chimotrypsyny wywierają swoje działania dopiero po aktywacji, ponieważ są one wytwarzane jako formy „prekursora” (zimogenu) zwane chemotropinogenną.
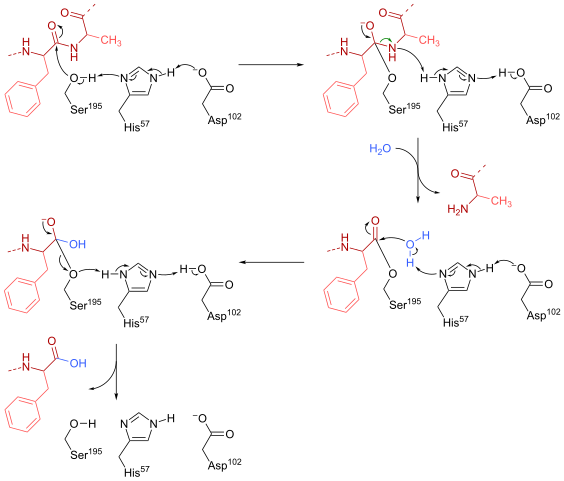 Mechanizm reakcji quimotrypsyny (źródło: HBF878 [CC0] przez Wikimedia Commons)
Mechanizm reakcji quimotrypsyny (źródło: HBF878 [CC0] przez Wikimedia Commons) Szkolenie
Zimogeny chimotrypsyny są syntetyzowane przez ogniwa Acinar trzustki, po czym migrują z retikulum endoplazmatycznego do kompleksu Golgiego, gdzie są pakowane w kompleksach błoniastych lub granulkach wydzielniczych.
Może ci służyć: nauki związane z biologiąTe granulki gromadzą się na końcach Acino i są uwalniane w odpowiedzi na bodźce hormonalne lub impulsy nerwowe.
Aktywacja
W zależności od warunków aktywacji można znaleźć kilka rodzajów chimotrypsyn, jednak wszystkie sugerują one proteolityczne „cięcie” łącza peptydowego w zimogenu, chimotrypsinogenu, procesie katalizowanym przez enzymin.
Reakcja aktywacji początkowo składa się z wiązania cięcia między aminokwasami 15 i 16 chimotrypsynogenu, które tworzy π-kwimotrypsynę, zdolną do „samookreślenia” i całkowitej aktywacji autokatalizy.
Działanie tego ostatniego enzymu promuje tworzenie peptydów razem za pomocą łańcucha C-końcowego, który zaczyna się od pozostałości 149).
Części odpowiadające odpadowi 14-15 i 147-148 (dwa dipéptides) nie mają funkcji katalitycznych i odłączają się od głównej struktury.
Aktywność katalityczna
Chimotrypsyna jest odpowiedzialna za hydrolizowanie wiązań peptydowych, głównie atakującą karboksylową część aminokwasów, które mają aromatyczne grupy boczne, to znaczy aminokwasy, takie jak tyrozyna, tryptofan i fenyloalanina.
Seryn (będący 195) w miejscu aktywnym (Gly-ASP-Series-Gly-Glu-Ala-Val) tego typu enzymów jest prawdopodobnie najważniejszą pozostałością do jego działania. Mechanizm reakcji jest następujący:
- Chimotrypsyna jest początkowo występująca w postaci „bez substratu”, w której katalityczna „triada” składa się z bocznej grupy karboksylowej pozostałości asparaginianowej (102), imidazolu reszty histydyny (57) i grupy bocznej hydroksylu hydroksylu z boku bocznego bocznego bocznego boku Serine (195).
- Podłoże spełnia enzym i łączy to, tworząc typowy kompleks odwracalny enzym-substran (zgodnie z modelem Micaelian), gdzie katalityczna „triada” ułatwia atak nukleofilowy poprzez aktywację grupy hydroksyl.
Może ci służyć: podstawy azotu: co to są, klasyfikacja, funkcje- Kluczowym punktem mechanizmu reakcji jest powstawanie połączenia częściowego, co powoduje polaryzację grupy hydroksylowej, co jest wystarczające do przyspieszenia reakcji.
- Po ataku nukleofilowym grupa karboksylowa staje się czworościennym pośrednikiem szsykowym, który jest stabilizowany przez dwa mosty wodorowe utworzone przez grupy N i H z reszty Gly 193 i miała 195.
- Oxyanion jest spontanicznie „przemieszczony” i powstaje enzymatyczny pośrednik, do którego dodano grupę acylową (enzym acydowy).
- Reakcja trwa wraz z wejściem cząsteczki wody do miejsca aktywnego, cząsteczki, która promuje nowy atak nukleofilowy, który powoduje powstawanie drugiego tetraedrycznego pośrednika, który jest również stabilizowany przez mosty wodorowe.
- Reakcja kończy się, gdy ten drugi pośrednik zostanie ponownie przełożony i tworzy ponownie kompleks enzymu-substratu micaelian, w którym aktywne miejsce enzymu jest zajęte przez produkt zawarty w grupie karboksylowej.
Bibliografia
- Appel, w. (1986). Chymotrypsyna: właściwości molekularne i katalityczne. Biochemia kliniczna, 19 (6), 317-322.
- Bender, m. L., Killheffer, j. V., & Cohen, s. (1973). Chymotrypsna. CRC Critical Reviews in Biochemistry, 1 (2), 149-199.
- Blow, d. M. (1971). 6 Struktura chymotrypsyny. W enzymach (vol. 3, pp. 185-212). Academic Press.
- Blow, d. M. (1976). Struktura i mechanizm chymotrypsyny. Rachunki badań chemicznych, 9 (4), 145-152.
- Nelson, zm. L., Lehninger, a. L., & Cox, m. M. (2008). Zasady biochemii lehninger. Macmillan.
- Polgár, l. (2013). Katalityczne mechanizmy peptydów seryny i treoniny. W podręczniku enzymów proteolitycznych (PP. 2524-2534). Elsevier Ltd.
- Westheimer, f. H. (1957). Hipoteza mechanizmu działania chymotrypsyny. Materiały z National Academy of Sciences of the United States of America, 43 (11), 969.
- « Synteza kwasu benzylowego, transpozycja i zastosowania
- Charakterystyka uczenia się wizualnego, strategie, działania, przykłady »

