Typy keratyny, struktura, lokalizacja i funkcje
- 4499
- 570
- Bertrand Zawadzki
keratyna Jest to nierozpuszczalne włókniste białko, które jest strukturalną częścią komórek i powłoki wielu organizmów, zwłaszcza zwierząt kręgowców. Ma bardzo różnorodne formy i jest mało reaktywny, chemicznie.
Jego struktura została po raz pierwszy opisana przez naukowców Linusa Paulinga i Roberta Coreya w 1951 roku, analizując strukturę włosów zwierząt. Ci naukowcy dali również wskazania na temat struktury miozyny tkanki mięśniowej
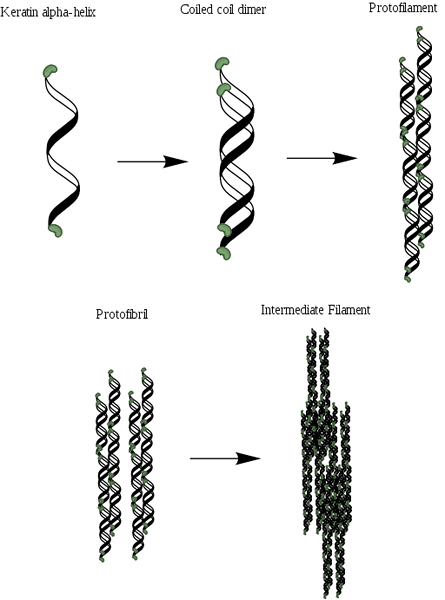
 Schemat organizacji Alfa-Queratin (źródło: MLPATTON [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons)
Schemat organizacji Alfa-Queratin (źródło: MLPATTON [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons) Po kolagenu jest to jedno z najważniejszych białek zwierząt i reprezentuje większość suchej masy włosów, wełny, paznokci, pazurów i kopyt, piór, rogów i znacznej części zewnętrznej warstwy skóry.
„Keratynizowane” elementy zwierząt mogą mieć bardzo różne morfologie, które w dużej mierze zależą od funkcji, którą wywierają w każdym konkretnym organizmie.
Keratyna jest białkiem, które ma cechy, które zapewniają dużą wydajność mechaniczną pod względem napięcia i kompresji. Jest wytwarzany przez specjalny rodzaj komórek, które nazywane są „keratynocytami”, które zwykle umierają po ich wytworzeniu.
Niektórzy autorzy potwierdzają, że keratyny są wyrażane na stadionie tkaniny i scenicznym. U ludzi istnieje ponad 30 genów kodujących te białka, które należą do rodziny, która ewoluowała przez kilka rund genetycznej powielania.
[TOC]
Rodzaje keratyn i ich struktury
Istnieją zasadniczo dwa rodzaje keratyny: α i β. Są one rozróżniane przez posiadanie podstawowej struktury, która składa się przede wszystkim z łańcuchów polipeptydowych, które można zapisać jako śmigiery alfa (α-zapytanie) lub łączą się równolegle jako arkusze umieszczone przez β (β-Cheap).
α-zapytanie
Ten typ keratyny jest najczęściej badany i wiadomo, że ssaki mają co najmniej 30 różnych wariantów tego typu keratyny. U tych zwierząt α-to jest częścią paznokci, włosów, rogów, hełmów, kolców i naskórka.
Podobnie jak kolagen, białka te zawierają w swojej strukturze obfity odsetek małych aminokwasów, takich jak glicyna i alanina, które umożliwiają ustanowienie śmigieł alfa. Struktura molekularna α-kweratyny składa się z trzech różnych regionów: (1) krystaliczne włókna lub śmigła, (2) końcowe domeny włókien i (3) macierzy.
Ścigi są dwa i tworzą dimer, który przypomina zwiniętą spiralę, która pozostaje zjednoczona dzięki obecności linków lub mostów disulfurowych (S-S). Każdy z śmigła ma około 3.6 odpadów aminokwasowych na każdym zakręcie, która daje i składa się z mniej więcej 310 aminokwasów.
Może ci służyć: flora i fauna Ekwadorii Sierra: reprezentatywne gatunkiTe zwinięte spirale można następnie powiązać z tworzeniem struktury zwanej protofilamentem lub protofibrylą, która ma zdolność do montażu z innymi tego samego typu.
Protofilamenty mają N- i C-końcówki nie helikalne, które są bogate w reszty cysteinowe i które są dołączone do regionu środkowego lub macierzy. Te cząsteczki polimeryzują, tworząc włókna pośrednie, które mają średnicę blisko 7 nm.
Wyróżnia się dwa rodzaje włókien pośrednich złożonych z keratyny: pośrednie kwaśne włókna (typ I) i podstawy (typ II). Są one osadzone w matrycy białkowej i sposób, w jaki te włókna są uporządkowane bezpośrednio, wpływa na właściwości mechaniczne struktury, która składa się.
W włóknach typu I śmigła łączą się ze sobą za pomocą trzech „spiralnych złączy” znanych jako L1, L12 i L2 i które, jak się uważa, zapewniają elastyczność domeny spiralnej. W włóknach typu II istnieją również dwie subdomeny, które należą do domen spiralnych.
Przykład struktury z α-kweratynami: włosy
Jeśli analizowana jest struktura typowych włosów, ma ona przybliżoną średnicę 20 mikronów i składa się z martwych komórek.
 Włosy ssaków, takie jak ta krowa, składają się z keratyny (źródło: Frank Winkler przez Pixabay.com)
Włosy ssaków, takie jak ta krowa, składają się z keratyny (źródło: Frank Winkler przez Pixabay.com) Makropibryle składają się z mikrofibryli, które mają mniejszą średnicę i są ze sobą połączone przez amorficzną substancję białkową o wysokiej zawartości siarki.
Te mikrofibryle są grupami mniejszych protofibryli o wzorze organizacji 9+2, co oznacza, że dziewięć protofibryll otacza dwa centralne protofibryle; Wszystkie te struktury składają się zasadniczo z α-kweratyny.
Miękkie keratyny i twarde keratyny
W zależności od zawartości siarki, α-kweratyny można klasyfikować jako miękkie keratyny lub twarde keratyny. Ma to związek z mechaniczną siłą oporności narzuconą przez połączenia disiarczkowe w strukturze białka.
W grupie twardych keratyn uwzględniane są te, które są częścią włosów, rogów i paznokci, a miękkie keratyny są reprezentowane przez włókna znalezione w skórze i kalutach.
Wiązania disiarczkowe można wyeliminować poprzez zastosowanie środka redukującego, więc struktury złożone z keratyny nie są łatwe do strawienia przez zwierzęta, chyba że mają jelita bogate w towary, podobnie jak w przypadku niektórych owadów.
Może ci służyć: ficologyβ-pytaniny
Β-to są znacznie silniejsze niż α-kweratyny i występują w gadach i ptakach w ramach pazurów, skal, piór i pików. W gekonach mikrowiain znaleziony w nogach (grzyby) składają się również z tego białka.
Jego struktura molekularna składa się z arkuszy β-Peelowanych utworzonych przez antyparałowe łańcuchy polipeptydowe, które wiążą się ze sobą poprzez wiązania lub mosty wodorowe. Te łańcuchy, obok siebie, tworzą małe sztywne i płaskie powierzchnie, lekko złożone.
Gdzie jesteś i jakie są twoje funkcje?
Funkcje keratyny są przede wszystkim powiązane z rodzajem budowy, którą buduje, i miejscem ciała zwierzęcia, w którym się znajduje.
Podobnie jak inne włókniste białka, przynosi to stabilność i sztywność strukturalną do komórek, ponieważ należy do wielkiej rodziny białka znanego jako rodzina włókien pośrednich, które są białkami cytoszkieletu.
W ochronie i zasięgu
Górna warstwa skóry górnych zwierząt ma dużą sieć pośrednie włókna utworzone przez keratynę. Ta warstwa nazywa się naskórek i ma od ludzi od 30 mikronów do 1 nm.
Naskórek działa jako bariera ochronna wobec różnych rodzajów stresu mechanicznego i chemicznego i jest syntetyzowana przez specjalny rodzaj komórek zwanych „keratynocytami”.
Oprócz naskórka istnieje jeszcze bardziej zewnętrzna warstwa, która ciągle się porusza.
Espinas i púas są również używane przez różne zwierzęta do własnej ochrony przed drapieżnikami i innymi agresorami.
„Pancerz” Pangolin, niektóre małe ssaki owadowskie, które zamieszkują Azję i Afrykę, składa się również z „łusek” keratyny, które je chronią.
W obronie i innych funkcjach
Rogi są obserwowane u zwierząt z rodziny Bovidae, to znaczy u krów, owców i kóz. Są to bardzo silne i odporne struktury, a zwierzęta, które mają ich zatrudnienie jako organy obrony i zalotów.
Rogi są tworzone przez centrum kostne złożone z „gąbczastej” kości pokrytych skórą rzutowaną ze strefy tylnej czaszki.
 Paznokcie to kolejny przykład części ciała złożonych z keratyny (źródło: ADOBE Stock przez Pixabay.com)
Paznokcie to kolejny przykład części ciała złożonych z keratyny (źródło: ADOBE Stock przez Pixabay.com) Pazury i paznokcie, oprócz ich funkcji w żywności i wsparciu, służą również zwierzętom jako „broń” obrony przed atakującymi i drapieżnikami.
Może ci służyć: teoria Fixist: koncepcja, postulaty i autorzyBird Peaks spełnia kilka celów, w tym jedzenie, obrona, zalot, wymiana ciepła i toaleta, między innymi. Wiele odmian picos u ptaków znajduje się w naturze, szczególnie pod względem kształtu, koloru, wielkości i siły powiązanych szczęk.
Piki są składane, podobnie jak rogi, przez centrum kostne rzutowane z czaszki i jest pokryte odpornymi arkuszami β-queratyny.
Zęby nielibulowanych zwierząt („rodowe” kręgowce) składają się z keratyny i, podobnie jak zęby „górnych” kręgowców, mają wiele funkcji w żywności i obronie.
W ruchu
Hełmy wielu zwierząt przeżuwaczych i ugulowanych (konie, osły, alce itp.) Składają się z keratyny, są bardzo odporne i zaprojektowane w celu ochrony nóg i współpracy w ruchu.
Pióra, które są również używane przez ptaki do poruszania się, składają się z β-tani. Struktury te mają ponadto funkcje kamuflażu, zalotów, izolacji termicznej i nieprzepuszczalności.
 Pióra i szczyt ptaków składają się również z keratyny (źródło: couleur, przez pixabay.com)
Pióra i szczyt ptaków składają się również z keratyny (źródło: couleur, przez pixabay.com) W przemyśle
Przemysł tekstylny jest jednym z głównych wyznawców struktur keratynizowanych. Wełna i włosy wielu zwierząt są ważne na poziomie przemysłowym, ponieważ wraz z nimi wytwarzane są różne ubrania, które są przydatne dla mężczyzn z różnych punktów widzenia.
Bibliografia
- Koolman, J., & Roehm, k. (2005). Atlas koloru biochemii (2 wyd.). Nowy Jork, USA: Thieme.
- Mathews, c., Van Holde, K., & Ahern, K. (2000). Biochemia (3 wyd.). San Francisco, Kalifornia: Pearson.
- Nelson, zm. L., & Cox, m. M. (2009). Zasady biochemii lehninger. Omega Editions (Ed.).
- Pauling, L., I Corey, R. (1951). Struktura włosów, mięśni i pokrewnych białek. Chemia, 37, 261-271.
- Phillips, d., Korge, ur., I James, w. (1994). Keratyna i keratynizacja. Journal of American Academy of Dermatology, 30(1), 85-102.
- Rouse, J. G., & Dyke, m. I. Iść. (2010). Przegląd biomateriałów opartych na keratynie do zastosowań biomedycznych. Materiały, 3, 999-1014.
- Smith, f. J. D. (2003). Genetyka molekularna zaburzeń keratyny. Am J Clin Dermatol, 4(5), 347-364.
- Voet, d., & Voet, J. (2006). Biochemia (3 wyd.). Pan -american Medical Redaktorial.
- Wang, ur., Yang, w., McKitrick, J., I Meyers, m. DO. (2016). Keratyna: struktura, właściwości mechaniczne, występowanie w organizmach biologicznych i wysiłki w bioinspiracji. Postęp w naukach materialnych.
- « Nowa Hiszpania i relacje z światowym tłem, trasy
- Charakterystyka uczenia się powtórzeń, zalety, wady »

