Przykłady alkilowo -halogenowe, uzyskiwanie przykładów
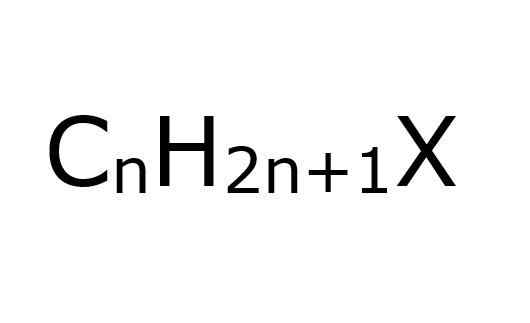
- 1545
- 125
- Pani Gilbert Stolarczyk
alkilowo -halogenomory Są to związki organiczne, w których atom węgla z hybrydyzacją SP3 Halogen jest połączony kowalencyjnie (F, Cl, Br, I). Z innej perspektywy wygodne jest uproszczenie, założenie, że są haloalcanos; Są to dla tych, które zostały zastąpione niektóre atomy halogenowe H.
Ponadto, jak sama nazwa wskazuje, atomy halogenowe muszą być powiązane z grupami alliquilowymi, R, aby być uważane za tego rodzaju halogendy; chociaż strukturalnie można je wymienić lub rozgałęzić i mieć pierścienie aromatyczne i nadal są alkilowym halogenkiem.
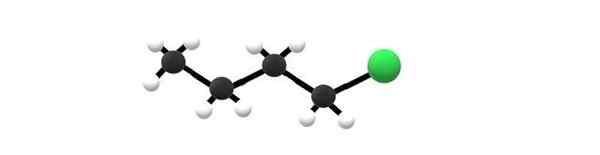 1-chlorobutano cząsteczka, przykład alkilowo-halogendu. Źródło: Gabriel Bolívar.
1-chlorobutano cząsteczka, przykład alkilowo-halogendu. Źródło: Gabriel Bolívar. Powyżej masz cząsteczkę 1-chlorobutano, która odpowiada jednemu z najprostszych alkilowo-halogenów. Można zauważyć, że wszystkie ich węgle mają proste wiązania, a także hybrydyzacja SP3. Dlatego zielona kula, odpowiadająca atomowi Cl, jest powiązana z szkieletem pochodzącym z butan alkan.
Przykłady nawet prostsze niż 1-chlorobutano to te pochodzące z gazu metanu: najmniejszy węglowodór ze wszystkich.
Z cząsteczki Cho4 Możesz zastąpić atomów H, powiedzieć, jod. Jeśli H zostanie wymienione, CH będzie3I (jodometan lub jodek metylu). Po wymianie dwóch H, CH będzie2Siema2 (Diyodometan lub jodek metylenowy). I wreszcie, wymieniam wszystkie H Diving Chi3 (jodoform) i CI4 (Tetrayoduro węglowe).
Czynsz halogenomoryczne charakteryzują się bardzo reaktywnym i, mając najbardziej elektrowni atomy okresowej tabeli, intuicja jest intuicja, że poprzez mechanizmy symfiny wywierają wpływ na matryce biologiczne.
[TOC]
Właściwości alkilowych halogenomonów
Właściwości tej rodziny związków zależą od jej struktur molekularnych. Jednak w porównaniu z różnicami ich alkanów, godne uwagi różnice spowodowane prostym faktem są linki C-X (X = atom halogenowy).
Oznacza to, że łącza C-X są odpowiedzialne za wszelkie różnice lub podobieństwo między jednym lub więcej alkilowymi halogenami.
Na początek łącza C-H są prawie apolarne, biorąc pod uwagę niską różnicę elektroungatywności między C i H; Zamiast tego łącza C-X mają stały moment dipolowy, ponieważ halogeny są bardziej elektrowni niż węgiel (zwłaszcza fluor).
Z drugiej strony niektóre halogeny są lekkie (F i CL), podczas gdy inne są ciężkie (BR i I). Jego masy atomowe również kształtują różnice w linkach C-X; A z kolei, bezpośrednio we właściwościach halogendu.
Dlatego dodanie halogenów do węglowodorów jest równe zwiększeniu jego polaryzacji i masy cząsteczkowej; To samo, aby było mniej niestabilne (do pewnego stopnia), mniej łatwopalne i zwiększyć punkty gotowania lub fuzji.
Punkty wrzenia i fuzji
Powyższe jest pokazane, w rosnącej kolejności, rozmiar, a zatem wagę różnych halogenów:
F < Cl < Br < I
Następnie oczekuje się, że alkilowo -halogendy zawierające atomy F są lżejsze niż te, które mają atomy BR lub I.
Na przykład rozważane są niektóre halogenury pochodzące z metanu:
Ch3F < CH3Cl < CH3Br < CH3Siema
Ch2F2 < CH2Cl2 < CH2Br2 < CH2Siema2
I tak dalej dla innych produktów pochodnych o wyższym stopniu fluorogennym. Zauważ, że porządek jest utrzymywany: fluorowe halogenomory są lżejsze niż jod. Nie tylko to, ale także punkty gotowania i fuzji również są zgodne z tym porządkiem; RF gotuje się w niższych temperaturach niż RI (R = CHO3, w tym przypadku).
Może ci służyć: aromatyczne podstawienie elektrofilowe: mechanizm i przykładyPodobnie wszystkie te ciecze są bezbarwne, ponieważ w swoich wiązaniach C-X elektrony nie mogą wchłonąć ani uwolnić fotonów, aby podróżować inne poziomy energii. Jednak gdy stają się cięższe, mogą krystalizować i wykazywać kolory (podobnie jak jodoform, chi3).
Biegunowość
Linki C-X różnią się od polaryzacji, ale w odwrotnej kolejności powyżej:
C-f> c-cl> c-Br> c-i
Dlatego łącza C-F są bardziej polarne niż linki C-I. Będąc bardziej polarnym, halogenomory RF mają tendencję do oddziaływania przez siły dipol-dipolo. Tymczasem w halogenurach RBR lub RI ich momenty dipolowe są słabsze, a interakcje rządzone przez londyńskie siły dyspersji zyskują większą siłę.
Moc rozpuszczalnika
Ponieważ alkilowo -halogendy są bardziej polarne niż alkan, z których pochodzą, zwiększają zdolność do rozpuszczenia większej liczby związków organicznych. Z tego powodu są to lepsze rozpuszczalniki; Chociaż nie oznacza to, że mogą zastąpić alkany we wszystkich aplikacjach.
Istnieją kryteria techniczne, ekonomiczne, ekologiczne i wydajności, aby preferować fluorogenny rozpuszczalnik od alkan.
Nomenklatura
Istnieją dwa sposoby nazwania alkilowego halogendu: po jego popularnej nazwie lub jego systematycznej nazwie (IUPAC). Wspólne nazwy są zwykle wygodniejsze w użyciu, gdy RX jest prosty:
Chcl3
Chloroform: nazwa zwyczajowa
Trichlorek metylu lub trichlorometanu: nazwa IUPAC.
Ale systematyczne nazwy są preferowane (i jedyną opcją), gdy mają rozgałęzione struktury. Jak na ironię, wspólne nazwy są ponownie przydatne, gdy struktury są zbyt skomplikowane (takie jak te, które będą widoczne w ostatniej sekcji).
Reguły, aby nazwać związek zgodnie z systemem IUPAC, są takie same jak w przypadku alkoholi: zidentyfikowano łańcuch główny, który jest najdłuższy lub najbardziej rozgałęziony. Następnie węgle są wymienione, zaczynając od końca najbliższych podstawników lub konsekwencji, nazywając porządek alfabetyczny.
Przykład
Aby to zilustrować, masz następujący przykład:
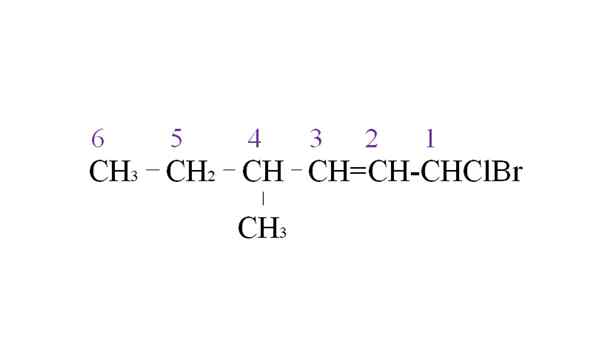 Wypożycz halogendy jako przykład nomenklatury. Źródło: Gabriel Bolívar.
Wypożycz halogendy jako przykład nomenklatury. Źródło: Gabriel Bolívar. Pierwsza gałąź to grupa metylowa w C-4; Ale posiadanie podwójnego wiązania tego wcześniejszego priorytetu przed wydaniem zasady. Z tego powodu najdłuższy łańcuch zaczyna być wymieniony z prawej strony, na czele z atomem węglowym połączonym z dwoma halogenami: CL i BR.
W przypadku wyliczenia podstawniki są wymienione w kolejności alfabetycznej:
1-bromo-1-clor-4-metylo-2-hexen.
Uzyskanie
Aby uzyskać halogendy alkilowe, cząsteczki muszą być przekazane do procesu halogenowania; to znaczy włączenie atomów halogenowych do ich struktur, szczególnie do atomu do węgla SP A3.
Istnieją dwie metody ich uzyskania lub syntezy: przez promieniowanie ultrafioletowe za pomocą mechanizmu wolnego rodnika lub przez dodanie hydracestów lub halogenów.
Halogenizacja z promieniowaniem światła lub ultrafioletowym
Pierwszy, najmniej odpowiedni i z najgorszym wydajnością, polega na napromieniowaniu alkanów z promieniowaniem ultrafioletowym (Hv) W obecności halogenu. Na przykład pokazano równania chlorowania metanu:
Ch4 + Cl2 => Ch3CL + HCl (pod światłem ultrafioletowym)
Ch3Cl + Cl2 => Ch2Cl2 + HCl
Ch2Cl2 + Cl2 => CHCl3 + HCl
Chcl3 + Cl2 => Ccl4 + HCl
Cztery związki (CH3Cl, rozdz2Cl2, Chcl3 i CCl4) Są one uformowane, a zatem istnieje mieszanka, którą można poddać destylacji ułamkowej. Jednak ta metoda nie jest bardzo praktyczna i preferowana jest ucieka się do syntezy organicznej.
Może ci służyć: kwas fenylooctowy: struktura, właściwości, zastosowania, efektyInnym przykładem jest bromation N-heksan:
Ch3Ch2Ch2Ch2Ch2Ch3 + Br2 => Ch3(BR) CHCH2Ch2Ch2Ch3 + Hbr
Ponownie, w tej reakcji promieniowanie światła lub ultrafioletowe stosuje się w celu sprzyjania tworzeniu się wolnych rodników. Brom, podobnie jak intensywna czerwona ciecz, jest odbarwiana podczas reagowania, obserwując w ten sposób czerwoną na kolorową zmianę koloru, gdy 2-bromoheksan.
Dodanie hydracestów lub halogenów do alkenów
Drugą metodą uzyskiwania alkilowo -halogenomurów jest leczenie alkoholi (ROH) lub alkenów (r2C = cr2) Z hydrace. Hydracidy mają ogólny wzór HX (HF, HCL, HBR i HI). Przykład zostanie pokazany przy użyciu etanolu dla każdego z nich:
Ch3Ch2OH + HF => CH3Ch2F + h2ALBO
Ch3Ch2OH + HCl => CH3Ch2CL + H2ALBO
Ch3Ch2OH + HBR => CH3Ch2Br + h2ALBO
Ch3Ch2Oh + hi => cho3Ch2I + H2ALBO
Również alkeny mogą dodawać cząsteczki HX do swoich podwójnych wiązań, tworząc wtórne alkilowo -halogenowelus.
Ch2= CH-CH3 + HBR => BRCH2-Ch2-Ch3 + Ch3-Chbr-ch3
Produkt BRCH2-Ch2-Ch3 To jest 1-bromopropano i cho3-Chbr-ch3 2-bromopropan. Drugi to produkt większości, ponieważ jest on o największej stabilności, podczas gdy ten pierwszy jest produkowany w mniejszym stopniu, ponieważ jest bardziej niestabilny. To dlatego, że Cho3Chbrch3 Jest to wtórny halogend alkilowy.
Bardzo podobne występuje, gdy dodawana do alkenu jest cząsteczka x2:
Ch2= CH-CH3 + Br2 => Brch2-Chbr-ch3
Uzyskuje się jednak alkilowo -halogenny z dwoma atomami bromu połączonymi z sąsiednimi węglemi; sąsiedztwo alkilowo -halogened. Gdyby, z drugiej strony, pobrano dwa bomo związane z tym samym węglem, nastąpiłby geminal alkilowo -halogenny, podobnie jak następujące:
Br2Ch-ch2-Ch3
Reakcje
Podstawienie nukleofilowe
Reaktywność alkilowo-halogenów jest w kruchości lub odporności łącza C-X. Im cięższy halogen, tym słabszy będzie wiązanie, a zatem łatwiej pęknie. W reakcji chemicznej są zepsute i powstają nowe; Linki C-X są zepsute, tworząc link C-G (G = nowa grupa).
Mówiąc bardziej odpowiedni, X działa jako grupa wychodząca, a G jako grupa przychodząca w reakcji Podstawienie nukleofilowe. Dlaczego ta reakcja się dzieje? Ponieważ X, będąc bardziej elektroongenacyjnym niż węgiel, „kradnie” gęstość elektroniczną, pozostawiając deficyt elektronów, który tłumaczy się jako dodatnie obciążenie częściowe:
Cδ+-Xδ-
Jeśli w pobliżu znajduje się gatunek ujemny (: g-) lub neutralne z parą dostępnych elektronów (: G), zdolnych do utworzenia bardziej stabilnego łącza C-G, X zostanie zastąpione przez G. Powyższe mogą być reprezentowane z następującym równaniem chemicznym:
RX +: G- => Rg + x-
Im słabszy łącze C-X lub R-X, tym większa jego reaktywność lub tendencja do zastąpienia przez Środek nukleofilowy (lub nukleofil) g; to znaczy miłośnicy jąder lub ładunki dodatnie.
Przykłady
Seria ogólnych równań podstawień nukleofilowych, które mogą cierpieć alkilowo -halogendydy, pokazano poniżej:
RX + OH- => Roh + x- (Alkohole)
+ Lub'- => Ror' (Ethers, Synthesis of Williamson)
+ Siema- => Ri (alkil yoduros)
+ Cn- => Rcn (nitrilos)
+ R'coo- => Rcoor '(estry)
+ NH3 => Rnh2 (Aminy)
+ P (c6H5)3 => RP (c6H5)3+ X- (Sole fosfonium)
+ CII- => Rsh (Tioles)
Może ci służyć: etapy chemiiZ tych przykładów można podejrzewać cenne alkilowe halogendy do syntezy organicznej. Jednym z wielu braków, której brakowało, jest reakcja Friedel Crafts, używana do „wynajem” pierścieni aromatycznych:
RX + ARH + ALCL3 => RRA
W tej reakcji H hnomatycznego pierścienia zastępuje się grupą R -z Rx.
Eliminacja
Wypożyczanie halogenów może uwalniać cząsteczki HX poprzez reakcję eliminacyjną; W szczególności odwodnienie:
R2CH-CXR2 + Oh- => R2C = cr2 + Hx
Mówi się, że występuje dehydrohalogenacja, ponieważ zarówno H, jak i X są tracone w tej samej cząsteczce Hx.
Synteza odczynnika Grignard
Czynsz halogendy mogą reagować na niektóre metale tworzące odczynnik Grignarda, używany do dodawania grup R do innych cząsteczek. Ogólne równanie jego syntezy jest następujące:
Rx + mg => rmgx
Przykłady
W sekcjach wspomniano już kilka przykładów alkilowych halogenomonów. Niektóre inne, proste, są:
-Chlorek etylu, CH3Ch2Cl
-Izopropil fluoruro (ch3)2Ch2F
-2-metylo-3-chloropentano, rozdz3-CH (rozdz3) -Chcl -ch2Ch3
-Secbutilo Yoduro, CH3Ch2Ch2I-ch3
-3-bromo-6-jodheptano, rozdz3-Ch2-Chbr-ch2-Ch2-Ch2Siema
-3.4-Dibromo-1-Penteno, rozdz3-CHBR-chbr-ch = ch2
Aplikacje
Rozpuszczalnik
W poprzednich sekcjach dokonano wzmianki o zdolności rozpuszczalnikowej alkilowo -halogenów. Z tej nieruchomości branża wykorzystała je jako środki czyszczące, albo w przypadku materii tekstylnej, komponentów elektronicznych lub usuwania plam lakier.
Są również używane jako rozpuszczalniki obrazów lub próbki organiczne lub tłuszczowe do niezliczonych rodzajów testów analitycznych.
Synteza organiczna
Czynsz halogenury są bardzo przydatne do „wynajmu” pierścieni aromatycznych, a jednocześnie służą jako źródło początkowe syntezy praktycznie wszystkich innych rodzin związków organicznych. Syntetycznie, RX jest uważane za źródło grup lub łańcuchów R, których można pożądać w celu włączenia wysoce aromatycznych związków.
Przemysł farmaceutyczny
Na początku wspomniano, że atomy halogenowe oddziałują z matrycami biologicznymi, więc w naszych organizmach nie mogą pozostać niezauważone bez generowania zmiany, pozytywnej lub negatywnej. Jeśli lek wywiera pozytywny wpływ na organizm, posiadanie atomu halogenowego, ten efekt może, ale nie musi wzrosnąć.
Tak więc, jeśli x jest bezpośrednio połączony węgiel z hybrydyzacją SP3, Będzie halogogened alkil. Niektóre z takich halogenomonów pokazano poniżej w poniższej serii obrazów:
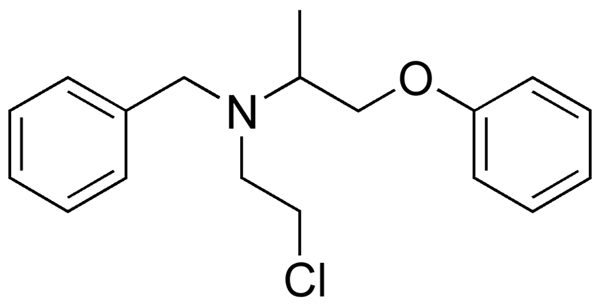 Fenoksybenzamina, lek stosowany do łączenia ciśnienia krwi u pacjentów z chromocytoma. Źródło: Utennt: Mark Pea [domena publiczna].
Fenoksybenzamina, lek stosowany do łączenia ciśnienia krwi u pacjentów z chromocytoma. Źródło: Utennt: Mark Pea [domena publiczna].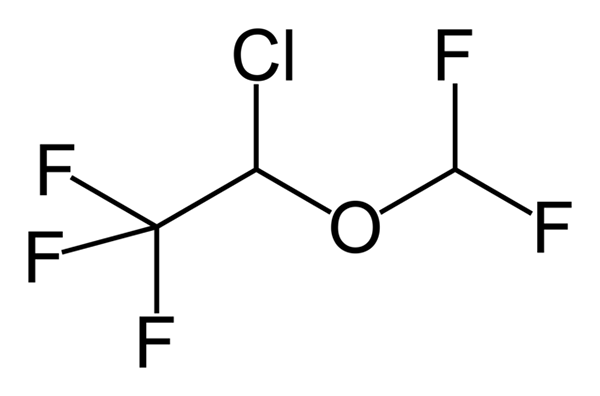 Isoflurano, anestetyka inhalacyjna. Źródło: Benjah-BMM27 [domena publiczna].
Isoflurano, anestetyka inhalacyjna. Źródło: Benjah-BMM27 [domena publiczna].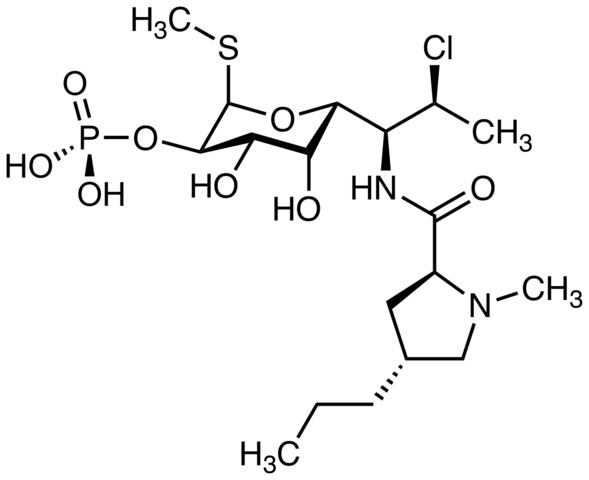 Klindamycyna, antybiotyk. Źródło: M Mitcheltrate [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)].
Klindamycyna, antybiotyk. Źródło: M Mitcheltrate [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)].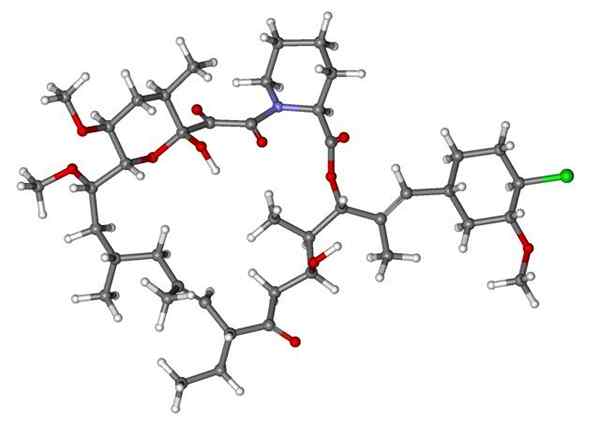 Pimecrolimus, stosowany w leczeniu atopowego zapalenia skóry. Czy możesz zlokalizować atom chloru? Źródło: Marinavladivok [CC0].
Pimecrolimus, stosowany w leczeniu atopowego zapalenia skóry. Czy możesz zlokalizować atom chloru? Źródło: Marinavladivok [CC0]. Halomon, możliwy środek przeciwwumowy i alkilowy halogenek z wodorostów alga Portieria HorneNiii, naturalne źródło. Źródło: Jü [domena publiczna]
Halomon, możliwy środek przeciwwumowy i alkilowy halogenek z wodorostów alga Portieria HorneNiii, naturalne źródło. Źródło: Jü [domena publiczna]
Zauważ, że w tych pięciu lekach istnieje co najmniej jeden link typu CHO2-X lub CH-X; To znaczy, halogen jest powiązany z SP -węglową3.
Czynniki chłodnicze
Słynny czynnik chłodniczy Freón-12 (chcif2), Podobnie jak inne fluoroalcanos lub hydrofluorokarbony, w tej funkcji zastąpili amoniak i chlorofluorokarbony (CFC), ponieważ nawet będąc substancjami nieolatywnymi lub toksycznymi, zniszczyły warstwę ozonową; Podczas gdy Freón-12, ponieważ jest bardziej reaktywny, zostaje zniszczony przed osiągnięciem takich wysokości.
Bibliografia
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Clark Jim. (14 lipca 2016 r.). Zastosowania halidów alkilowych. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Gál, ur., Bucher, c., & Burns, n. Z. (2016). Chiralne halogenki alkilowe: niedoświetlone motywy w medycynie. Morskie leki, 14 (11), 206. Doi: 10.3390/MD14110206
- Halogenki alkilowe. Źródło: chemed.Chem.Purdue.Edu
- Patkar Prachi. (16 lipca 2017 r.). Wszystko o halogenkach alkilowych: właściwości, zastosowaniach i wielu innych. Science STRUCT. Odzyskane z: Scienceruck.com
- R. statek. (2016). Halogenki alkilowe. Odzyskane z: Hiperphysics.Phy-orst.GSU.Edu
- Przewodnik uczenia się dla rozdziału 9 - halogenki alkilowe I. Odzyskane z: kaktus.Dixie.Edu
- Q.DO. Eduardo Vega Barrios. (S.F.). Wypożycz halogenuros: właściwości, zastosowania i aplikacje. [PDF. Odzyskane z: cvonline.Uaeh.Edu.MX
- « Struktura kwasu azotu (HNO2), właściwości, synteza
- Struktura bromku litowego, właściwości, zastosowania, ryzyko »

