Struktura bromku litowego, właściwości, zastosowania, ryzyko
- 4506
- 68
- Eugenia Czapla
On Bromid litowy Jest to neutralna sól z metalu alkalicznego, którego wzorem chemicznym jest Libr. Wzór wyraża, że jego krystaliczna substancja stała składa się z jonów Li+ i br- W stosunku 1: 1. Twoje kryształy są białe lub lekkie beżowe. Jest bardzo rozpuszczalny w wodzie, a także jest raczej higroskopową solą.
Ta ostatnia właściwość umożliwia wykorzystanie jej jako wysusza w systemach klimatyzacji i chłodzenia. Podobnie bromid litowy stosowano od początku XX wieku w leczeniu niektórych zaburzeń zdrowia psychicznego, porzucając jego użycie z powodu niewłaściwego użycia soli.
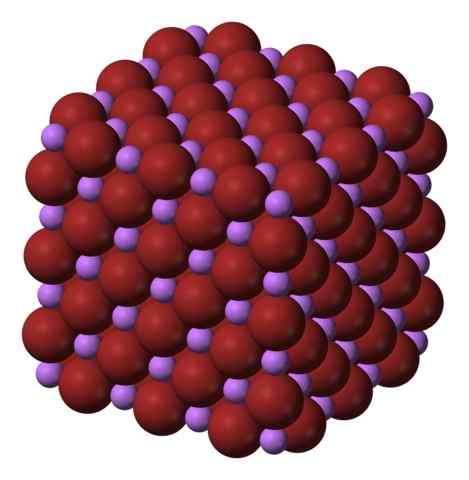
 Sześcienna krystaliczna struktura Libr. Źródło: Benjah-BMM27 przez Wikipedia.
Sześcienna krystaliczna struktura Libr. Źródło: Benjah-BMM27 przez Wikipedia. LIB jest wytwarzany przez obróbkę węglanu litu, Li2WSPÓŁ3, z kwasem bromhyterowym. Po ociepleniu pożywki wytrąca się w roztworze wodnym jako hydrat.
Ta sól podrażnia skórę i oczy kontaktem, jednocześnie powodując podrażnienie przewodów oddechowych przez inhalację. Spożycie soli litowych może powodować nudności, wymioty, biegunkę i zawroty głowy.
[TOC]
Struktura bromku litu
Formuła Libr wyjaśnia, że proporcja Li/Br jest równa 1; Dla każdego kationu li+ Musi być anion BR- odpowiednika. Dlatego ten odsetek musi być utrzymywany na stałym poziomie w każdym rogu kryształu Libr.
Jony li+ i br- Przyciągają się nawzajem, zmniejszając odpychanie między równymi obciążeniami, aby spowodować klejnot kryształów sześciennych; To jest izomorficzne do NaCl (obraz doskonały). Zauważ, że cały zestaw ma geometrię sześcienną.
W tym kryształu Li+ Są mniejsze i mają lekki fioletowy kolor; podczas gdy br- Są bardziej nieporęczne i intensywny brązowy kolor. Obserwuje się, że każdy jon ma sześciu sąsiadów, co jest takie samo, jak powiedzenie, że przedstawiają oktaedryczną koordynację: Libr6 lub li6Br; Jeśli jednak wzięto pod uwagę komórkę jednolitą, proporcja li/br pozostaje 1.
Może ci służyć: struktura krystalicznaTo jest krystaliczna struktura przyjęta najlepiej przez Libr. Może jednak tworzyć inne rodzaje kryształów: Wurzita, jeśli krystalizuje w niskich temperaturach (-50 ° C) na podłożu; o sześcienne wyśrodkowane na ciele lub typu cscl, jeśli szklana sól jest poddawana pod wysokim ciśnieniem.
Hydraty i szkło
Powyższe ma zastosowanie do bezwodnego. Ta sól jest higroskopijna i dlatego może pochłaniać wilgoć środowiska, przeplatając cząsteczki wody w własne kryształy. W ten sposób powstają hydraty libr · nh2Lub (n = 1, 2, 3 ..., 10). Dla każdego hydratu struktura krystaliczna jest inna.
Na przykład badania krystalograficzne wykazały, że litr · h2Lub przyjąć strukturę typu Perovskita.
Gdy hydraty te są w roztworze wodnym, mogą się przepełnić i witrować; To znaczy przyjmują krystaliczną, ale nieuporządkowaną strukturę molekularną. W takich warunkach mosty wodorowe stają się dość ważne.
Nieruchomości
Waga molekularna
88 845 g/mol.
Wygląd
Biała krystaliczna stała lub lekka beżowa.
Zapach
Toaleta.
Temperatura topnienia
552 ° C (1.026 ºF, 825 K).
Punkt wrzenia
1.256 ° C (2.309 ° F, 1.538 K).
Rozpuszczalność wody
166,7 g/100 ml w 20 ° C. Zwróć uwagę na swoją wysoką rozpuszczalność.
Rozpuszczalność w rozpuszczalnikach organicznych
Rozpuszczalne w metanolu, etanolu, eterze i acetonie. Nieco rozpuszczalne w pirydynie, związku aromatycznym i mniej polarnym niż poprzednie.
Wskaźnik refrakcji (ηd)
1 784.
Pojemność kaloryczna
51,88 J/mol · k.
Standardowa entropia molowa (sθ 298)
66,9 J/mol · k.
punkt zapłonu
1.265 ° C. Jest uważane za niefalalne.
Stabilność
Stabilny. Jednak postać anodry jest wyjątkowo higroskopijna.
Rozkład
Kiedy rozkłada się przez ocieplenie, powoduje tlenek litu.
Może ci służyć: kwas chlorogenowyPh
Między pH 6 a 7 w roztworze wodnym (100 g/l, 20 ° C).
Reaktywność
Bromid litowy nie jest reaktywny w normalnych warunkach środowiskowych. Jednak możesz doświadczyć intensywnych reakcji z silnymi kwasami, gdy temperatura rośnie.
Podczas rozpuszczania się w wodzie następuje wzrost temperatury, spowodowany przez ujemną entalpię nawodnienia.
Produkcja
Libr występuje przez reakcję wodorotlenku litu lub węglanu litu z kwasem bromhytymu w reakcji neutralizacji:
Li2WSPÓŁ3 + HBR => Libr +CO2 + H2ALBO
Bromid litowy uzyskuje się jako hydrat. Aby uzyskać bezwodną postać, konieczne jest podgrzanie uwodnionej soli pod próżnią.
Nomenklatura
Nazwa „Bromidu litu” wywodzi się z bycia metalicznym halogenkiem, nazwanym zgodnie z nomenklaturą zapasową. Inne nazwy, równie ważne, ale mniej używane, są monobromury litu, zgodnie z systematyczną nomenklaturą; i bromid lityczny (unikalna wartościowość +1 dla litu), zgodnie z tradycyjną nomenklaturą.
Aplikacje
Desiccant
Libr to sól higroskopijna, tworząca skoncentrowaną solankę zdolną do wchłaniania wilgoci powietrza w szerokim zakresie temperatur. Ta solanka jest używana jako wysyłka w systemach klimatyzacji i chłodzenia.
Włókna
Służy do zwiększenia objętości wełny, włosów i innych włókien organicznych.
Addukty farmaceutyczne
LIB tworzy addukty z niektórymi związkami farmaceutycznymi, modulując jego działanie. Addukt to kombinacja poprzez koordynację dwóch lub więcej cząsteczek, bez strukturalnej zmiany któregokolwiek z zjednoczonych cząsteczek.
Środek uspokajający
Bromid litowy zastosowano na początku jako środek uspokajający w niektórych zaburzeniach psychicznych, przestań używać w 1940 r. Obecnie stosuje się węglan litowy; Ale w każdym razie lit jest elementem, który wywiera działanie terapeutyczne w obu związkach.
Może ci służyć: tlenek hydrauliczny (PBO): wzór, właściwości, ryzyko i zastosowaniaLit jest stosowany w leczeniu choroby afektywnej dwubiegunowej, ponieważ był przydatny w kontroli maniakalnych epizodów zaburzenia. Uważa się, że lit hamuje aktywność pobudzających neuroprzekaźników, takich jak dopamina i kwas glutaminowy.
Z drugiej strony aktywność układu hamującego za pośrednictwem neuroprzekaźnika kwasu gamma-amino-butynowego (GABA) wzrasta (GABA). Działania te mogą być częścią podstaw działania terapeutycznego litu.
Ryzyko
Skontaktuj się z toksycznością
Podrażnienie skórne i uczulenie, alergie. Poważne urazy oczu lub podrażnienie oka, na dróg oddechowych, nozdrzy i gardła.
Przyjmowanie pokarmu
Głównymi objawami z powodu spożycia bromku litu są: zaburzenia żołądkowo -jelitowe, wymioty i nudności. Inne niekorzystne skutki na spożycie soli obejmują pobudzenie, skurcze i utrata przytomności.
Stan znany jako „bromizm” może wystąpić z dawką litu -bromil większą niż 225 mg/dzień.
W bromizmie mogą wystąpić niektóre z następujących objawów i objawów: zaostrzenie trądziku i utrata apetytu, drżenie, problemy mowy, apatia, osłabienie i maniakalne pobudzenie.
Bibliografia
- Preparat chemiczny. (2019). Bromid litowy. Odzyskane z: preparat quimica.com
- David c. Johnson. (10 lipca 2008 r.). Nowe zamówienie na bromek litowy. Natura. doi.Org/10.1038/454174a
- Aayushi jain & r.C. Dixit. (S.F.). Przejście fazy strukturalnej w bromku litu: wpływ ciśnienia i temperatury. [PDF]. Odzyskane z: NCPCM.W
- Takamuku i in. (1997). Badania dyfrakcji rentgenowskiej na roztworach bromidu litowego i jodku litowego litowego. Wydział Chemii, Wydział Nauki, Fukuoka University, Nanakuma, Jonan-Ku, Fukuoka 814-80, Japonia.
- National Center for Biotechnology Information. (2019). Bromid litowy. Baza danych Pubchem, CID = 82050. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Wikipedia. (2019). Bromid litowy. Źródło: w:.Wikipedia.org
- Royal Society of Chemistry. (2019). Bromid litowy. Chemspider. Odzyskany z: Chemspider.com
- « Przykłady alkilowo -halogenowe, uzyskiwanie przykładów
- Meksyk w XVIII -wiecznych aktach i zmianach społeczno -ekonomicznych »

