Struktura kwasu azotu (HNO2), właściwości, synteza

- 1701
- 161
- Pani Waleria Marek
On kwas azotowy Jest to słaby, kwas nieorganiczny, którego wzorem chemicznym jest HNO2. Jest zasadniczo w wodnym roztworze z jasnoniebieskim zabarwieniem. Jest bardzo niestabilny i szybko jest podzielony na tlenek azotu, nie, a w kwasie azotowym INO3.
Zwykle jest w roztworze wodnym w postaci azotynów. Naturalnie pochodzi również z atmosfery w wyniku reakcji tlenku azotu z wodą. Tam, szczególnie w troposferze, kwas azotu pośredniczy w regulacji stężenia ozonu.
 Roztwór kwasu azotu w zlewce. Źródło: Brak, który można odczytać, nie dostarczył autora. Przyjął szalony naukowiec ~ Commonswiki (na podstawie roszczeń związanych z prawem autorskim). [Domena publiczna]
Roztwór kwasu azotu w zlewce. Źródło: Brak, który można odczytać, nie dostarczył autora. Przyjął szalony naukowiec ~ Commonswiki (na podstawie roszczeń związanych z prawem autorskim). [Domena publiczna] Na górnym obrazie pokazano rozwiązanie HNO2 gdzie widać charakterystyczny jasnoniebieski kolor tego kwasu. Jest syntetyzowany przez rozpuszczanie tritledu azotu, n2ALBO3, W wodzie. Podobnie jest to produkt zakwaszenia roztworów azotynów sodu w niskich temperaturach.
HNO2 Ma niewielkie użycie komercyjne, używając w postaci azotynów w ochronie mięsa. Z drugiej strony jest używany w opracowaniu barwników azoickich.
Jest stosowany wraz z tiosiarczanem sodu, w leczeniu pacjentów z zatruciem cyjankiem sodu. Ale jest to środek mutagenny i uważa się, że może powodować podstawienia w podstawach łańcuchów DNA, poprzez deaminację oksydacyjną cytozyny i adeniny.
Kwas azotu ma podwójne zachowanie, ponieważ może zachowywać się jako środek oksydacyjny lub jako środek redukujący; Oznacza to, że można go zmniejszyć do NO lub N2, utleniać3.
[TOC]
Struktura kwasu azotu
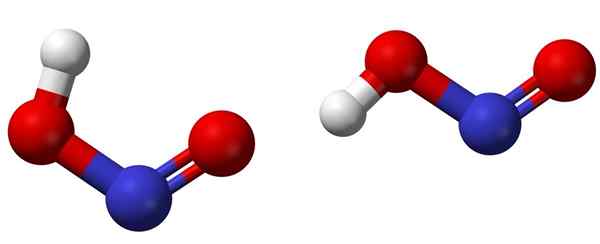 Izomery CI (po lewej) i trans (prawe) z odpowiednimi strukturami molekularnymi HNO2. Źródło: Ben Mills [domena publiczna].
Izomery CI (po lewej) i trans (prawe) z odpowiednimi strukturami molekularnymi HNO2. Źródło: Ben Mills [domena publiczna]. Górny obraz pokazuje strukturę molekularną kwasu azotowego za pomocą modelu kulek i prętów. Atom azotu (kula niebieska) znajduje się w środku struktury, tworząc podwójne wiązanie (n = O) i prosty (N-O) z atomami tlenu (czerwone kule).
Zauważ, że atom wodoru (biała kula) jest powiązany z jednym z tlenu, a nie bezpośrednio z azotem. Wiedząc o tym, strukturalna formuła HNO2 Jest to [ho-n = o] lub [no (oh)] i nie ma takiego łącza H-N (jak może myśleć wzór chemiczny).
Cząsteczki obrazu odpowiadają cząsteczkom fazy gazowej; W wodzie są one otoczone cząsteczkami wody, które mogą zaakceptować jon wodoru (słabo), aby nie utworzyć jonów2- i H3ALBO+.
Może ci służyć: BeakerJego struktury mogą przyjąć dwie formy: cis lub trans, zwane izomerami geometrycznymi. W izomerze CIS atom H jest zaćmiony sąsiednim atomem tlenu; Podczas gdy w izomerze trans, oba występują w pozycjach anty -oppozytowych.
W izomerze CIS prawdopodobne jest powstawanie wodoru wewnątrzcząsteczkowego (OH-NO), które może importować międzycząsteczkowe (onoh-onoh).
Nieruchomości
Nazwy chemiczne
-Kwas azotowy
-Kwas dwoksonowy (III)
-Wodorotlenek nitrowozylu
-Hydroksydoksydonitogen (systematyczna nazwa IUPAC)
Opis fizyczny
Jasnoniebieska ciecz, odpowiadająca roztworu azotynowego.
Waga molekularna
47 013 g/mol.
Stała dysocjacji
Jest to słaby kwas. Jego PKA wynosi 3,35 do 25 ° C.
Temperatura topnienia
Jest znany tylko w roztworze. Dlatego nie można obliczyć twojej temperatury topnienia, ani nie można izolować twoich kryształów.
Punkt wrzenia
Nie istnieją czyste, ale w wodzie, pomiary tej właściwości nie są precyzyjne. Z jednej strony zależy to od stężenia HNO2, A z drugiej strony jego ocieplenie powoduje rozkład. Dlatego nie zgłoszono dokładnej temperatury wrzenia.
Formacja sprzedaży
Azotyny rozpuszczalne w wodzie z LI+, Na+, K+, AC2+, Pan2+, BA2+. Ale nie tworz soli z wszechstronnym kationami, takimi jak: do3+ i/lub być2+ (ze względu na wysoką gęstość obciążenia). Jest w stanie tworzyć stabilne estry z alkoholem.
Potencjał ognia
Jest łatwopalny do reakcji chemicznych. Może eksplodować przez kontakt z fosforem trichlorek.
Rozkład
Jest to bardzo niestabilny związek, aw wodnym roztworze rozkłada się w tlenku azotu i kwasie azotowym:
2 HNO2 => Nie2 + No +H2ALBO
4 HNO2 => 2 hno3 + N2Lub +h2ALBO
Środek redukujący
Kwas azotu w roztworze wodnym przedstawiono w postaci jonów azotynowych, nie2-, które doświadczają kilku reakcji redukcji.
Reaguje z jonami i- i wiara2+, w postaci azotynu potasowego, tworząc tlenek azotu:
2 Kno2 + Ki +h2południowy zachód4 => I2 + 2 NO +2 H2Lub +k2południowy zachód2
Azotyn potasu w obecności jonów cyny jest zmniejszony do tworzenia tlenku azotu:
Kno2 + 6 HCl +2 SNCL2 => 2 SNCL4 + N2O +3 godz2O +2 kcl
Może ci służyć: wodorotlenek berylowy (be (OH) 2)Azotyn potasu jest zmniejszany przez Zn w środowisku alkalicznym, tworząc amoniak:
5 godzin2O +kno2 + 3 Zn => NH3 + KOH +3 Zn (OH)2
Środek utleniający
Oprócz tego, że jest środkiem redukującym, kwas azotu może interweniować w procesach utleniania. Na przykład: utlenij się do siarkowodoru, stając się tlenek azotowy lub amoniak, w zależności od kwasowości pożywki, w której zachodzi reakcja.
2 HNO2 + H2S => s +2 nr +2 h2ALBO
Hno2 + 3 godz2S => s +nh3 + 2 godz2ALBO
Kwas azotu, w pożywce pH, może utleniać jon jodowy do jodu.
Hno2 + Siema- + 6 godz+ => 3 i2 + NH3 + 2 godz2ALBO
Możesz także działać jako agent redukujący działający na Cu2+, powodując kwas azotowy.
Nomenklatura
Do HNO2 Możesz podać inne nazwy, które zależą od rodzaju nomenklatury. Kwas azotu odpowiada tradycyjnej nomenklaturze; Kwas dwoksonowy (III), do nomenklatury zapasowej; i dioksonitan (III) wodoru, do systematycznego.
Synteza
Kwas azotu można zsyntetyzować przez rozpuszczenie trójtlenku azotu w wodzie:
N2ALBO3 + H2O => 2 hno2
Inną metodą przygotowania jest reakcja azotynu sodu, nano3, z kwasami mineralnymi; takie jak kwas wodny i kwas bromhyterowy. Reakcja jest wykonywana w niskiej temperaturze, a kwas azotu jest spożywany na miejscu.
Starszy brat3 + H+ => HNO2 + Na+
H+ Pochodzi z HCL lub HBR.
Ryzyko
Biorąc pod uwagę jego właściwości chemiczne i cechy, niewiele jest informacji na temat bezpośrednich toksycznych skutków HNO2. Być może pewne szkodliwe skutki, które są uważane, są wytwarzane przez ten związek, są faktycznie spowodowane kwasem azotowym, który może wystąpić przez rozkładanie kwasu azotowego.
Wskazano, że HNO2 Może mieć szkodliwy wpływ na drogi oddechowe i być w stanie wywołać objawy podrażnienia u pacjentów z astmą.
W postaci azotynu sodu jest on zmniejszany przez deoksyhemoglobinę, wytwarzając tlenek azotu. Jest to potężny rozszerzający naczynia krwionośne, który powoduje rozluźnienie mięśni gładkich naczyniowych, szacując u ludzi dawkę LD50 35 mg/kg do konsumpcji doustnej.
Toksyczność azotynów sodu przejawia się z zapadnięciem się sercowo -naczyniowym, a następnie ciężkim niedociśnieniem, z powodu działania naczyń rozszerzających naczynia krwionośne, wytwarzane z azotynu.
Dwutlenek azotu, nie2, Obecny w zanieczyszczonym powietrzu (smog), w określonych warunkach może powodować kwas azotu; co z kolei może reagować z aminami z tworzenia nitrozaminy, gamma związków rakotwórczych.
Może ci podać: tlenku srebra (AG2O)Podobna reakcja występuje wraz z dymem papierosów. Znaleziono pozostałości nitrozaminy przylegających do wewnętrznej podszewki pojazdów palenia.
Aplikacje
Produkcja sprzedaży Diazonium
Kwas azotu jest stosowany w branży w produkcji soli diazoniowej, poprzez jego reakcję z aromatycznymi aminami i fenolami.
Hno2 + Rnah2 + H+ => RNA = nar +h2ALBO
Sole diazonium stosuje się w reakcjach syntezy organicznej; Na przykład w reakcji Sandmeyera. W tej reakcji występuje wymiana grupy aminowej (h2N-), w pierwotnej aromatycznej aminie, przez grupy CL-, Br- i Cn-. Aby uzyskać te produkty aromatyczne, wymagane są sole Coupro.
Sole diazoniowe mogą tworzyć genialne związki dachowe, które są używane jako barwniki, a także służyć jako test jakościowy do wykrycia obecności aromatycznych amin.
Eliminacja sodu Azida
Kwas azotu służy do wyeliminowania azydów sodu3), co jest potencjalnie niebezpieczne dla jego tendencji do wykorzystywania.
2 Nan3 + 2 HNO2 => 3 N2 + 2 No +2 NaOH
Synteza Oxymas
Kwas azotu może reagować z grupami ketonowymi, tworząc oxymas. Można je utlenić w celu utworzenia karboxilów lub zmniejszenia kwasu, aby spowodować aminę.
Proces ten jest stosowany w komercyjnym przygotowaniu kwasu tłuszczowego, monomeru stosowanego w produkcji nylonowej. Interweniuje również w produkcji poliuretanu, a jego estrów są plastyfikatory, głównie w PVC.
Pod postacią soli fizjologicznej
Kwas azotu, w postaci azotynu sodu, jest stosowany w obróbce i ochronie mięsa; Ponieważ zapobiega wzrostowi bakterii i jest w stanie reagować z mioglobiną, wytwarzając ciemnoczerwony kolor, który sprawia, że mięso jest bardziej atrakcyjne dla konsumpcji.
Ta sama sól jest stosowana wraz z tiosiarczanem sodu, w dożylnym obróbce zatrucia cyjanku sodu.
Bibliografia
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. Aminy. (10th Wydanie.). Wiley Plus.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Pubchem. (2019). Kwas azotowy. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Softschools. (2019). Kwas azotowy. Odzyskane z: Softschools.com
- Wikipedia. (2019). Kwas azotowy. Źródło: w:.Wikipedia.org
- Royal Society of Chemistry. (2015). Kwas azotowy. Odzyskany z: Chemspider.com
- Encyklopedia Nowego Świata. (2015). Kwas azotowy. Odzyskane z: Newworldyclopedia.org
- Bank narkotykowy. (2019). Kwas azotowy. Wyjazd z: Banku Drug.AC
- Preparat chemiczny. (2018). Hno2. Odzyskane z: preparat quimica.com
- « Liczby lub wskaźniki, które mówią o postępach edukacyjnych w danym kraju
- Przykłady alkilowo -halogenowe, uzyskiwanie przykładów »

