Charakterystyka katalazy, struktura, funkcje, patologie
- 2723
- 467
- Pani Waleria Marek
katalaza Jest to enzym oksydoreduktazy (oksydorredytraza H2O2: H2O2) szeroko rozpowszechniany w naturze. Katalizatory, w różnych tkankach i typach komórek, reakcja „rozkładu” nadtlenku wodoru w tlenu i wodzie cząsteczkowej.
Pierwsze obserwacje tego rodzaju enzymu sięgają wczesnych lat 1810.
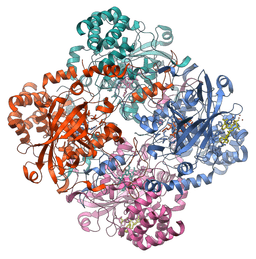
 Struktura molekularna enzymu katalazy (źródło: Vossman [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] przez Wikimedia Commons)
Struktura molekularna enzymu katalazy (źródło: Vossman [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] przez Wikimedia Commons) Ten enzym, kluczowe dla utrzymania integralności komórkowej i głównego regulatora metabolizmu nadtlenku wodoru, był podstawowym czynnikiem w celu potwierdzenia, że w naturze istnieją enzymy, które działają na określone substraty.
Ssaki i inne organizmy mają enzymy katali, które mogą również zachowywać się jak peroksydazy, katalizując reakcje utleniające różne substraty za pomocą nadtlenku wodoru.
U większości eukariotów enzymy katali są przeważnie w podkomórkowych organellach zwanych „peroksysomami”, a u ludzi istnieje wiele warunków patologicznych związanych z niedoborem tego enzymu.
[TOC]
Charakterystyka
Aktywność enzymów, takich jak katalaza, może się znacznie różnić w zależności od rodzaju rozważanej tkanki. Na przykład u ssaków aktywność katalazy jest znacząca zarówno w nerkach, jak i w wątrobie, i jest znacznie niższa w tkankach łącznych.
Tak, że katalaza u ssaków jest głównie związana ze wszystkimi tkankami, które mają znaczący metabolizm aerobowy.
Ssaki mają katale zarówno w mitochondriach, jak i w peroksysomach, a w obu przedziałach są enzymy związane z błonami organizmu. Przeciwnie, w erytrocytach aktywność katalazy wiąże się z rozpuszczalnym enzymem (pamiętaj, że erytrocyty mają rzadkie organelle wewnętrzne).
Może ci służyć: pół Stuart: fundament, przygotowanie i zastosowaniaKatalaza jest enzymem o dużej liczbie zastępczych lub stałych katalitycznych (jest bardzo szybka i wydajna) oraz ogólną reakcją, że katalizatory jest następujące:
2H2O2 → 2H2O + O2
Na przykład w obecności niskich stężeń nadtlenku wodoru ssaka zachowuje się jak oksydaza, przy użyciu tlenu cząsteczkowego (O2) w celu utleniania cząsteczek, takich jak indol i β-penyloetyloamina, prekursory aminokwasu tryptofanowego i neuroprzekaźnik, odpowiednio.
Niektóre konkurencyjne inhibitory aktywności katalazy są obecnie znane, a wśród nich wyróżniają. Azida, w postaci anionowej, jest potężnym inhibitorem innych białek z grupami hemo i jest stosowana do eliminacji lub zapobiegania wzrostowi mikroorganizmu w różnych warunkach.
Struktura
U ludzi katalaza jest kodowana przez gen 34 kb, który ma 12 intronów i 13 eksonów i koduje białko aminokwasowe 526.
Większość badanych katali to enzymy tetrameryczne o masie cząsteczkowej zbliżonej do 240 kDa (60 kDa dla każdej podjednostki), a każdy monomer jest związany z grupą protetyczną heminy lub ferroprotoporfiryny.
Jego struktura składa się z czterech domen złożonych ze struktur wtórnych utworzonych przez alfa hellice i arkusze β, a badania przeprowadzone w enzymie wątroby ludzi i bydła wykazały, że białka te są powiązane z czterema cząsteczkami NADPH.
Te cząsteczki NADPH nie wydają się niezbędne dla enzymatycznej aktywności katalazy (do wytwarzania wody i tlenu z nadtlenku wodoru), ale wydaje się, że odnosi się to do zmniejszenia podatności tego enzymu w porównaniu z wysokim stężeniami jego toksycznego substratu podłoża.
Domeny każdej podjednostki w katalazie ludzi to:
Może ci służyć: karotenoidy-Wydłużone nielobalne ramię N-końcowe, które działa na stabilizację struktury czwartorzędowej
-Barórka β ośmiu przeciwparallów β-kratowych, które dostarczają niektórych bocznych reszt połączeń dla grupy HEMO
-Domena „owijania” otaczającej domenę zewnętrzną, w tym grupa hemo i, wreszcie
-Domena ze strukturą śmigła alfa
Cztery podjednostki, z tymi czterema domenami, są odpowiedzialne za tworzenie długiego kanału, którego rozmiar jest kluczowy dla mechanizmu rozpoznawania nadtlenku wodoru przez enzym (który wykorzystuje dla niej aminokwasy, takie jak histydyna, asparagina, glutamina i kwas asparaginowy ).
Funkcje
Według niektórych autorów katalaza wypełnia dwie funkcje enzymatyczne:
-Rozkład nadtlenku wodoru w wodzie cząsteczkowej i tlenu (jako specyficzna peroksydaza).
-Utlenianie dawców protonów, takich jak metanol, etanol, wiele formalnych fenoli i kwas, przy użyciu mola nadtlenku wodoru (takiego jak niespecyficzna peroksydaza).
-W erytrocytach duża ilość katalazy wydaje się odgrywać ważną rolę w ochronie hemoglobiny przed środkami utleniającymi, takimi jak nadtlenek wodoru, kwas askorbinowy, metylohydrazyna i inne.
Enzym obecny w tych komórkach jest odpowiedzialny za obronę innych tkanek o niewielkiej aktywności katalazy w porównaniu z wysokimi stężeniami nadtlenku wodoru.
-Niektóre owady, takie jak chrząszcz bombowca, używają katalazy jako mechanizmu obronnego, jako nadtlenku wodoru i rozkładają się i używają produktu tlenu gazowego wspomnianego reakcji w celu napędzania mocy wody i innych związków chemicznych w postaci.
-W roślinach katalaza (również obecna w peroksysomach) jest jednym ze składników mechanizmu fotorerycznego, podczas którego fosfoglikinian wytwarzany przez enzym Rubisco jest stosowany do produkcji 3-fosfoglikanuanu.
Może ci służyć: cykl LoosPowiązane patologie u ludzi
Głównymi źródłami produkcji substratu katalazy, nadtlenku wodoru, są reakcje katalizowane przez enzymy oksydazy, reaktywne formy tlenu i niektóre komórki nowotworowe.
Związek ten bierze udział w procesach zapalnych, w ekspresji cząsteczek adhezyjnych, w apoptozie, w regulacji agregacji płytek krwi i w kontroli proliferacji komórek.
Gdy występują niedobory tego enzymu, generowane są wysokie stężenia jego substratu, co wytwarza zmiany w błonie komórkowej, wady transportu elektronicznego w mitochondriach, w metabolizmie homocysteiny i DNA.
Wśród chorób związanych z mutacjami w genie kodującym dla katalazy ludzi:
-Mellitus Diabetes
-Nadciśnienie tętnicze
-Alzheimer
-Biećcie i inne
Bibliografia
- Agar, n., Sadrzadeh, s., Findo, str., & Eaton, j. (1986). Katalaza erytrocytów. Somatyczna obrona utleniacza? J. Clin. Inwestować., 77, 319-321.
- Góth, L., Rass, str., & Zapłacić. (2004). Mutacje enzymów katalazy i ich związek z projektami. Diagnoza molekularna, 8(3), 141-149.
- Kirkman, godz., & Gaetanit, g. F. (1984). Katalaza: enzym tetrameryczny z czterema ściśle związanymi cząsteczkami NADPH. Proc. Natl. Acade. Sci. Zastosowania, 81, 4343-4347.
- Kirkman, godz. N., I Gaetani, G. F. (2006). Katalaza ssaków: czcigodny enzym z nowymi tajemnicami. Trendy w naukach biochemicznych, 32(1), 44-50.
- Rawn, J. D. (1998). Biochemia. Burlington, Massachusetts: Neil Patterson Publishers.
- Salomon, e., Berg, L., & Martin, D. (1999). Biologia (Ed.). Philadelphia, Pensylwania: Saunders College Publishing.
- Vinshtein, ur., Melilik-Adamyan, w., Barynin, v., Pochwa, a., & Grebenko, a. (1981). Trójwymiarowa struktura katalazy enzymu. Natura, 293(1), 411-412.
- « Charakterystyka Lacasas, struktura, funkcje
- Równomiernie przyspieszone charakterystyka ruchu prostoliniowego, wzory »

