Struktura węglanu litowa (LI2CO3), właściwości, wykorzystuje

- 3802
- 252
- Paweł Malinowski
On węglan litowy Jest to nieorganiczna substancja stała utworzona przez dwa litowe li+ i węglanowy CO32-. Jego formuła chemiczna to li2WSPÓŁ3. Li2WSPÓŁ3 Jest to biała krystaliczna substancja stała, którą można uzyskać przez reakcję między wodorotlenkiem litu a dwutlenek węgla.
Węglan litowy ma bardzo wysoki punkt fuzji, więc jest stosowany w przygotowaniu szkła, ceramiki i porcelany. Ma bardzo zróżnicowane zastosowania, takie jak akumulatory litowe, w przygotowaniu innych związków litowych, elektrod spawalniczych oraz obrazów i lakierów.
 Lit węglan li2WSPÓŁ3 solidny. Zdjęcie wykonane przez W: Użytkownik: Walkerma w czerwcu 2005 roku. Źródło: Wikimedia Commons.
Lit węglan li2WSPÓŁ3 solidny. Zdjęcie wykonane przez W: Użytkownik: Walkerma w czerwcu 2005 roku. Źródło: Wikimedia Commons. LI jest również używane2WSPÓŁ3 W mieszaninach cementowych w celu osiągnięcia szybkiego ustawienia i produkcji aluminium.
Jednym z jego najważniejszych zastosowań jest leczenie niektórych chorób psychicznych, takich jak depresja i nadmiernie agresywne zachowania, między innymi.
Jednak jego zastosowanie jako leku musi być należycie kontrolowane przez specjalistów medycznych, ponieważ ludzie leczeni LI2WSPÓŁ3 Mogą ponieść szkodliwe skutki dla zdrowia, takie jak niedoczynność tarczycy (zmniejszona funkcja tarczycy).
[TOC]
Struktura
Węglan litowy składa się z dwóch litowych li+ i węglanowy CO32-.
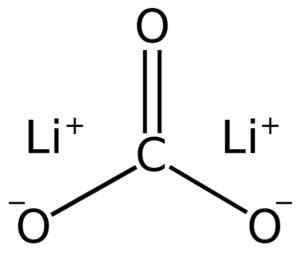 Struktura węglanu litowa litowa2WSPÓŁ3. Adrian Hands [domena publiczna]. Źródło: Wikimedia Commons.
Struktura węglanu litowa litowa2WSPÓŁ3. Adrian Hands [domena publiczna]. Źródło: Wikimedia Commons. Elektroniczna konfiguracja litu w stanie utleniania +1 wynosi 1s2 2s0, Cóż, stracił elektron ostatniej warstwy, a zatem był bardziej stabilny. Jon węglanowy Co32- Ma płaską konstrukcję.
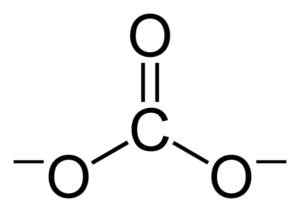 Płaska struktura jonu węgla Co32-. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons.
Płaska struktura jonu węgla Co32-. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons. Obciążenia ujemne są równo rozmieszczone między trzema atomami tlenu jonu węgla Co32-.
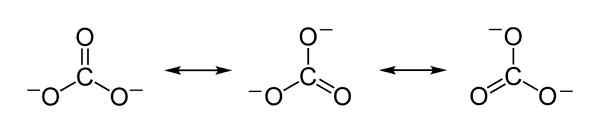 Teoretyczne struktury rezonansu jonu węglanowego Co32- które służą do wyjaśnienia sprawiedliwego rozkładu obciążeń ujemnych między 3 atomami tlenu. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons.
Teoretyczne struktury rezonansu jonu węglanowego Co32- które służą do wyjaśnienia sprawiedliwego rozkładu obciążeń ujemnych między 3 atomami tlenu. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons. Nomenklatura
-Węglan litowy
-DILITio węglan
Właściwości fizyczne
Stan fizyczny
Krystaliczne białe stałe struktury monoklinicznej
Waga molekularna
73,9 g/mol
Temperatura topnienia
723 ºC
Rozkład
Rozkłada się na 1300 ° C.
Gęstość
2,11 g/cm3
Rozpuszczalność
Niewiele rozpuszczalny w wodzie: 1,31 % wagi w temperaturze 20 ° C. Jego rozpuszczalność w wodzie maleje wraz ze wzrostem temperatury. Jest rozpuszczalny w rozcieńczonych kwasach. Jest nierozpuszczalny w alkoholu i acetonu.
Może ci służyć: tlenek baru (BAO): struktura, właściwości, zastosowania, ryzykoPh
Roztwory wodne są alkaliczne, mają pH większy niż 7.
Właściwości chemiczne
Li2WSPÓŁ3 Jest hydrolizowany w roztworze wodnym wytwarzającym podstawowy roztwór. Niewielki odsetek związku, który jest rozpuszczony w wodzie, pozostawia anion węglanowy32-.
Anion węglanowy CO32- Bezpłatny w roztworze wodnym wymaga protonu, tworząc anion wodorowęglanowy HCO3-, Jak widać w następującej reakcji:
WSPÓŁ32- + H2O → HCO3- + Oh-
Obecność jonów OH- To właśnie sprawia, że rozwiązanie jest podstawowe.
Właściwości biologiczne
W tkankach zwierzęcych i ludzkich zwykle występują ślady litu, ale do momentu, gdy nie znana jest naturalna fizjologiczna rola tego jonu.
W organizmie ludzkim Li2WSPÓŁ3 spożywane jako leki, działa na różne mechanizmy sygnalizacyjne w neuronach i innych komórkach. Wynika to z wymiany kationów, takich jak sód i potas.
Włączenie jonu litowego do struktury błony komórkowej może zmienić odpowiedź na hormony i sprzężenie komórek z procesami energetycznymi.
W ten sposób lit modyfikuje kilka procesów komórkowych, w tym metabolizm.
Poprzez modyfikację sposobu, w jaki komórki działają2WSPÓŁ3 Możesz działać na mechanizmach komunikacyjnych neuronów w mózgu.
Uzyskanie
Li2WSPÓŁ3 Można go uzyskać za pomocą reakcji wodorotlenku litu z dwutlenkiem węgla Co2, Jak pokazano niżej:
2 lioh + co2 → Li2WSPÓŁ3 + H2ALBO
Występuje komercyjnie z minerałów zawierających lit, taki jak spodumen i lepidolit. Te minerały są traktowane w wysokich temperaturach niektórymi solami siarczanowymi lub związkami alkalicznymi w celu uzyskania soli litowych.
Otrzymane sole litowe są oczyszczane roztworami wody lub kwas2WSPÓŁ3.
Jednak Li2WSPÓŁ3 Osiągnięte w ten sposób jest zanieczyszczone siarczanami lub chlorkami wapnia, magnezem, żelazem, sodem, potasem itp. Więc wymagają późniejszego oczyszczania.
Aplikacje
W leczeniu chorób psychicznych
Jest stosowany jako środek przeciwdepresyjny, środek przeciwmaniakowy, w leczeniu zachowań agresywno-impulsyjnych i zaburzeń dwubiegunowych (ludzie, którzy nagle zmieniają swój humor bez żadnej przyczyny, stają się gwałtowne).
Może ci służyć: 20 przykładów sublimacji chemicznej i cech Niektóre agresywne zaburzenia impulsywne można traktować Li za pomocą Li2WSPÓŁ3. Autor: Prrawny. Źródło: Pixabay.
Niektóre agresywne zaburzenia impulsywne można traktować Li za pomocą Li2WSPÓŁ3. Autor: Prrawny. Źródło: Pixabay. Lekarze zaobserwowali, że ich podawanie prowadzi do zmniejszenia intensywności i częstotliwości ciężkich okresów depresji i epizodów maniakalnych.
Jest stosowany sam, to znaczy bez żadnego dodatkowego związku, w terapii podtrzymującej depresji jednobiegunowej i zaburzenia schizoecificznego. Służy również do zwiększenia działań przeciwdepresyjnych innych leków.
Chociaż był stosowany w leczeniu dzieci z pozornymi objawami zaburzenia afektywnego dwubiegunowego i nadpobudliwości z składnikami neurotycznymi lub agresywnymi, nie był skuteczny we wszystkich przypadkach.
W leczeniu objawów innych chorób
Służy do zmniejszenia częstotliwości silnych bólów głowy, powtarzających się i przewlekłego.
Służy do zmniejszenia częstości zakażenia u pacjentów z chemioterapią neutropeniczną lub innymi powodami. Neutropenia to spadek neutrofili, rodzaj białych krwinek, które pomagają w walce z infekcjami w organizmie.
Został zastosowany jako inhibitor enzymu tarczycy w leczeniu nadczynności tarczycy, ale nie jest preferowane leczenie ze względu na jego działania niepożądane.
Forma administracji
Jest używany w postaci tabletek lub kapsułek2WSPÓŁ3. Również w tabletkach powolnych z cytrynianem litowym. LI jest preferowane2WSPÓŁ3 Ponieważ nie podrażnia gardła podczas go połykania, tak jak dzieje się to z innymi solami litowymi.
 Autor: Pete Lyforth. Źródło: Pixabay.
Autor: Pete Lyforth. Źródło: Pixabay. Niekorzystne skutki
Li2WSPÓŁ3 Może mieć szkodliwy wpływ na tarczycę i nerki, więc funkcja tych narządów musi być monitorowana przed i podczas leczenia tym związkiem.
Li2WSPÓŁ3 Może być toksyczny w stężeniach bardzo blisko tych zatrudnionych w leczeniu, więc wymagany jest ciągły przegląd ich wartości surowicy krwi.
LI Objawy zatrucia2WSPÓŁ3 Są to między innymi drżenie, skurcze mięśni, osłabienie mięśni, biegunka, wymioty, senność lub ataksja (pogorszenie koordynacji mięśni),.
Na początku lirapii2WSPÓŁ3 Mogą również wystąpić objawy takie jak drżenie, bóle głowy i nudności. Ale one zwykle znikają poprzez dalsze leki.
Może ci służyć: HolmioWiększość leczonych ludzi może również rozwinąć leukocytozę (wzrost liczby białych krwinek), ale jest to odwracalne.
Ludzie, którzy są leczni z Li2WSPÓŁ3 Nie powinni obsługiwać pojazdów ani obsługiwać maszyn, ponieważ zmniejsza to koordynację fizyczną i zdolność do wykonywania czynności, które należy ostrzec.
Przypadki, w których nie należy go podawać
Nie należy go stosować u dzieci poniżej 12 lat, ponieważ może zakłócać tworzenie kości i ich gęstość, ponieważ zmienia stężenie hormonu tarczycy. Zwykle zajmuje miejsce wapnia w kościach.
Nie należy ich traktować Li2WSPÓŁ3 Osoby z chorobą sercowo -naczyniową, nerkami lub tarczycą. Ani u pacjentów z poważnie odwodnionymi.
Nie należy podawać kobiet w ciąży, szczególnie w pierwszym trymestrze ciąży. Lit przecina łożysko i może łatwo docierać do płodu z możliwymi efektami teratogennymi, to znaczy może wytwarzać anomalie lub wady rozwojowe u dziecka.
Osoby starsze, które wymagają leczenia LI2WSPÓŁ3 Powinny być leczone z dużą ostrożnością i dawkami niższymi niż dawkami młodych dorosłych, ponieważ mogą rozwinąć chorobę niedoczynności tarczycy.
Inne zastosowania
Li2WSPÓŁ3 Wysoka czystość jest szeroko stosowana w produkcji akumulatorów litowych.
Jest stosowany w stopionych węglowych ogniwach paliwowych.
Jest stosowany w produkcji porcelany elektrycznej, która jest rodzajem porcelany izolacyjnej elektrycznej. Jest również stosowany w produkcji oszklenia na ceramice.
 Li2WSPÓŁ3 Służy do wytwarzania porcelany elektrycznej, która jest używana jako izolator energii elektrycznej, na przykład w słupkach elektrycznych. FIR0002 Flagstoffotos [at] Gmail.com Canon 20D + Tamron 28-75 mm f/2.8 [GFDL 1.2 (http: // www.gnu antylopa.Org/licencje/stare licencje/FDL-1.2.html)]. Źródło: Wikimedia Commons.
Li2WSPÓŁ3 Służy do wytwarzania porcelany elektrycznej, która jest używana jako izolator energii elektrycznej, na przykład w słupkach elektrycznych. FIR0002 Flagstoffotos [at] Gmail.com Canon 20D + Tamron 28-75 mm f/2.8 [GFDL 1.2 (http: // www.gnu antylopa.Org/licencje/stare licencje/FDL-1.2.html)]. Źródło: Wikimedia Commons. Pozwala przygotować ceramikę o niskim współczynniku rozszerzalności, to znaczy, że rozszerza się bardzo niewiele podczas zwiększania temperatury, więc ceramika może być stosowana w wyższym przedziale temperatury.
Inne z jego zastosowań są katalizatorem, w produkcji innych związków litowych, takich jak elektrody spawalnicze, w luminescencyjnych formuł, lakiery i barwniki, a także w produkcji elektrolitycznej aluminiowej.
Przydaje się do generowania szybszego ustawienia cementu i dodaje do kleju płytek, aby można je było naprawić w krótkim czasie.
 Autor: Capri23auto. Źródło: Pixabay.
Autor: Capri23auto. Źródło: Pixabay. Bibliografia
- Cai, w. i in. (2018). Usunięcie tego42- z Li2WSPÓŁ3 przez rekrystalizację w Na2WSPÓŁ3. Crystals 2018, 8, 19. MDPI odzyskało.com.
- Gadikota, g. (2017). Połączenie zmian strukturalnych morfologicznych i krystalicznych podczas konwersji monohydratu wodorotlenku litu do węglanu litu za pomocą wielu pomiarów rozpraszania promieniowania rentgenowskiego. Minerals 2017, 7, 169. MDPI odzyskało.com.
- LUB.S. National Library of Medicine. (2019). Węglan litowy. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov.
- Kirk-Othmer (1994). Encyklopedia technologii chemicznej. Czwarta edycja. John Wiley & Sons.
- Encyklopedia chemii przemysłowej Ullmanna. (1990). PIĄTA EDYCJA. VCH Verlagsgellschaft MBH.
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- « Przykłady wewnętrznych i zewnętrznych kątów sprzężonych, ćwiczenia
- .Kwas stearynowy (CH3 (CH2) 16cooh) Struktura, właściwości, zastosowania »

