Struktura jodku potasu (KI), właściwości, uzyskiwanie, zastosowania, ryzyko

- 4453
- 1086
- Estera Wojtkowiak
On jodek potasu Jest to związek nieorganiczny utworzony przez jon potasowy (k+) i jon jodkowy (i-). Jego formuła chemiczna to ki. Jest to biała krystaliczna substancja stała o naturze jonowej i jest bardzo rozpuszczalna w wodzie.
KI pozwala na kilka reakcji chemicznych i analizy i służy do pomiaru ilości ozonu w atmosferze. Jest również wykorzystywany w sprzęcie analizy podczerwieni (IR).
 Jodek stałego Ki Ki. Ondřej Mang [domena publiczna]. Źródło: Wikimedia Commons.
Jodek stałego Ki Ki. Ondřej Mang [domena publiczna]. Źródło: Wikimedia Commons. Jodek potasu jest dodawany do wspólnej soli stołowej, aby zapobiec niedoborze jodu u ludzi, ponieważ może to stanowić poważny problem zdrowotny.
Jest stosowany jako wykrztuśny, ponieważ pomaga, że śluz może łatwo płynąć z kanałów oddechowych na zewnątrz. Służy również do leczenia niektórych infekcji grzybów i jest stosowany w niektórych kosmetykach.
Jest używany przez lekarzy weterynaryjnych do leczenia zwierząt z problemami podobnymi do ludzi, takich jak kaszel i infekcje skóry. Jest nawet dodawany do zwierząt w bardzo niewielkich ilościach dla zwierząt.
[TOC]
Struktura
Jodek potasu jest związkiem jonowym utworzonym przez kation potasowy k+ I anion Yoduro I-, Dlatego między nimi łącze jest jonowe. Status utleniania potasu wynosi +1, a jod Valencia del to -1.
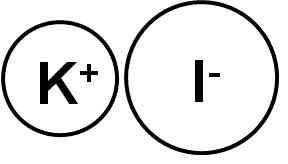 Jodek potasowy jest związkiem jonowym. Autor: Marilú Stea.
Jodek potasowy jest związkiem jonowym. Autor: Marilú Stea. Ki Kryształy jodku potasu są sześcienne.
 Struktura jodku potasu Ki. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons.
Struktura jodku potasu Ki. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons. Nomenklatura
- Jodek potasu
- Jodek potasu
Nieruchomości
Stan fizyczny
Krystaliczna biała stała. Kryształy sześcienne.
Waga molekularna
166 003 g/mol
Temperatura topnienia
681 ° C
Punkt wrzenia
1323 ° C
Gęstość
3,13 g/cm3
Rozpuszczalność
Bardzo rozpuszczalny w wodzie: 149 g/100 g wody w 25 ° C. Lekko rozpuszczalne w etanolu i eterze.
Może ci służyć: neon: historia, właściwości, struktura, ryzyko, użyciaPh
Jego wodne roztwory są neutralne lub alkaliczne, z pH od 7 do 9.
Właściwości chemiczne
Lekko higroskopowe w wilgotnym powietrzu.
Jest stabilny w suchym powietrzu. Światło i wilgotność przyspieszają jego rozkład i zmiany koloru na żółty z powodu uwalniania niewielkich ilości jodu (i2) i Yodatos (IO3-).
Z czasem roztwory wodne Ki stają się żółte, jednak przy odrobinie alkalii można tego uniknąć.
Te rozwiązania rozpuszczają się na jod (i2) Dając ki3:
Siema- + Siema2 → i3-
Inne właściwości
Ma mocno gorzki i soli fizjologiczny. To nie jest łatwopalne.
Uzyskanie
Jodek potasu można uzyskać przez ogrzewanie jodu (i2) W stężonym roztworze wodorotlenku potasu (KOH):
3 i2 + 6 Koh → 5 Ki + Kio3 + H2ALBO
Powstały roztwór yodato i jodku jest podgrzewany w celu wyeliminowania wody, jest redukowany do suchości, węgiel dodaje się i podgrzewa w wysokiej temperaturze. Węgiel pobiera tlen z jodu i utlenia dwutlenek węgla, zmniejszając w ten sposób jodek do jodku:
2 Kio3 + C → 2 Ki + 3 Co2
Otrzymany jodek potasowy można ponownie zarekfrytować, aby go oczyścić. Oznacza to, że jest na nowo odkryty w wodzie i skłania się ponownie do krystalizacji.
Aplikacje
W leczeniu nadczynności tarczycy
Jodek potasu służy jako dodatkowe leczenie wraz z innymi środkami przeciwtarbarnymi w leczeniu nadczynności tarczycy.
Nadczynność tarczycy jest chorobą, która powoduje, że tarczyca wytwarza zbyt dużo hormonu tarczycy, ze zwiększoną wielkością tarczycy, zmniejszoną masą osoby, przyspieszonym bicie serca i drażliwości, wśród innych objawów.
 Kobieta z zapaleniem tarczycy. Można go leczyć jodkiem Ki potasu. https: // www.Myupchar.com/in [cc by-sa (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons.
Kobieta z zapaleniem tarczycy. Można go leczyć jodkiem Ki potasu. https: // www.Myupchar.com/in [cc by-sa (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons. U pacjentów z nadczynnością tarczycy KI szybko zmniejsza objawy, ponieważ hamuje uwalnianie hormonu tarczycy.
Jego efekty tarczycy są: zmniejszenie ilości naczyń krwionośnych gruczołu, potwierdzenie ich tkanek i zmniejszyło wielkość ich komórek.
Z tego powodu dotyczy to leczenia przedoperacyjnego w celu wywołania inwolucji lub zmniejszenia wielkości tarczycy przed tarczycą (usunięcie tarczycy), ponieważ operacja ta jest ułatwiona.
Może ci służyć: sód: historia, struktura, właściwości, ryzyko i zastosowaniaW innych zastosowaniach medycznych
Jodek potasu ma właściwości wykrztuśne wraz ze wzrostem wydzielania płynów oddechowych, co powoduje zmniejszenie lepkości śluzu.
 Jodek potasu może działać jako wykrztuśanie w leczeniu kaszlu. Autor: аастаball геп. Źródło: Pixabay.
Jodek potasu może działać jako wykrztuśanie w leczeniu kaszlu. Autor: аастаball геп. Źródło: Pixabay. Służy do leczenia rumienia guzkowego, który jest bolesnym stanem zapalnym w nogach, w których powstają zaczerwienione guzki i zwiększona temperatura.
Jest środkiem antyhongos. Pozwala leczyć sporotrozę, która jest infekcją skóry spowodowaną grzybem. Ta choroba zdarza się osobom pracującym z roślinami i ziemiami, takimi jak rolnicy i ogrodnicy.
Jest również stosowany w leczeniu niedoboru jodu lub w celu uniknięcia go, a zatem dodaj do soli stołowej lub soli jadalnej (chlorek sodu) jako źródło jodu, a czasem w wodzie do picia.
W aplikacjach weterynaryjnych
Jodek potasu podaje się zwierzętom jako przeciwdziałającym, w celu zwiększenia i upodobań płynów dróg oddechowych, do przewlekłego kaszlu oskrzeczowego, a także w przypadkach reumatyzmu i jako przeciwzapalnych.
Służy również do mikozy (infekcji grzybiczych) zwierząt, w celu zmniejszenia swędzenia i przewlekłego zatrucia ołowiu lub rtęci.
W ochronie tarczycy w nagłych wypadkach radioaktywnych
Jodek potasu ma właściwości ochronne tarczycy w przypadku, gdy dana osoba była narażona na promieniowanie jądrowe.
KI zalewa tarczycę nieradyaktywną jodem, blokując w ten sposób przyjmowanie radioaktywnych cząsteczek i wchłanianie radioaktywnego jodu, chroniąc tarczycę przed rakiem, który może powodować promieniowanie.
W pomiarach ozonu w atmosferze
Gaz ozonowy (lub3) Można go zmierzyć w atmosferze za pomocą ogniw elektrolitycznych zwanych Ozonosandas, które są transportowane przez balony radiosondasowe.
Może ci służyć: Benchilo BenzoateTe elektrolityczne komórki zawierają roztwór jodku KI potasu. Komórki są początkowo w równowadze chemicznej i elektrycznej.
Kiedy próbka powietrza z ozonem (lub3) Penetruje jedną z komórek, równowaga jest złamana, ponieważ następuje następująca reakcja:
2 ki + lub3 + H2O → i2 + ALBO2 + 2 Koh
Ta reakcja wytwarza prąd elektryczny, który przepływa między komórkami.
Ilość wytwarzanego prądu elektrycznego jest stale przesyłana przez fale radiowe na stacji na lądzie. W ten sposób uzyskuje się profil ozonu od ziemi do wysokości piłki.
 Balon -ff -off with Radiosonda z Ki do pomiaru ozonu. Hannes Grobe 19:27, 20 czerwca 2007 r. (UTC), Alfred Wegener Institute for Polar and Marine Research, Bremerhaven, Niemcy [CC By-SA (https: // CreativeCommons.ORG/Licencje/BY-SA/2.5)]. Źródło: Wikimedia Commons.
Balon -ff -off with Radiosonda z Ki do pomiaru ozonu. Hannes Grobe 19:27, 20 czerwca 2007 r. (UTC), Alfred Wegener Institute for Polar and Marine Research, Bremerhaven, Niemcy [CC By-SA (https: // CreativeCommons.ORG/Licencje/BY-SA/2.5)]. Źródło: Wikimedia Commons. W kilku zastosowaniach
Jodek potasu pozwala również:
- Eliminacja wolnych rodników, takich jak rodnik hydroksylowy OH.
- Produkcja emulsji fotograficznych, aby wytrącić srebro.
- Poprawić paszę zwierząt po dodaniu w mikrokontontach.
- Dezodoryzować nawóz bydła.
- Przekazywać światło widma podczerwieni w urządzeniach analizy IR.
- Wykonać pewne reakcje chemiczne i analizy w laboratoriach chemii.
- Używaj go w produktach higieny osobistej.
- Przeprowadzić analizę zanieczyszczenia środowiska.
Ryzyko
Niektórzy ludzie wrażliwi na jodek.
Osoby z gruźlicą lub ostrym zapaleniem oskrzeli również powinny być ostrożne.
Ki może powodować zmiękczenie gruczołów ślinowych, może spalić usta lub gardło, niezwykły wzrost śliny, ból zęba i zapalenie dziąseł i metaliczny smak, wśród innych objawów.
Możesz także podrażniać oczy i otworzyć rany na skórze.
Bibliografia
- LUB.S. National Library of Medicine. (2019). Jodek potasu. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Kirk-Othmer (1994). Encyklopedia technologii chemicznej. Czwarta edycja. John Wiley & Sons.
- Dean, J.DO. (redaktor). (1973). Podręcznik chemii Lange. Elementh Edition. McGraw-Hill Book Company.
- Valkovic, v. (2019). Odkażanie po ekspozycji na promieniowanie. Najbardziej wrażliwe części ciała. W radioaktywności w środowisku (druga edycja). Odzyskane z naukowym.com.
- Smit, h.G.J. (2015). Chemia obserwacji atmosfery chemii (in situ). W Encyklopedii nauk atmosferycznych (wydanie drugie). Odzyskane z naukowym.com.
- Muralikrishna, i.V. i manickam, v. (2017). Analityczne metody monitorowania ankietowania środowiska. W zarządzaniu środowiskiem. Odzyskane z naukowym.com.
- Wallace, J.M. i Hobbs, P.V. (2006). Chemia atmosferyczna 1. W nauce atmosferycznej (wydanie drugie). Odzyskane z naukowym.com.

