Zmiany typów stanu i ich cechy (z przykładami)
- 4009
- 688
- Estera Wojtkowiak
zmiany stanu lub faza to zjawisko termodynamiczne, w którym materia doświadcza odwracalnych zmian fizycznych. Mówi się, że jest termodynamiczny, ponieważ przenoszenie ciepła występuje między materią a otoczeniem; Lub co jest takie samo, istnieją interakcje między materią a energią, które indukują przegrupowanie cząstek.
Cząstki, które doświadczają zmiany statusu, pozostają takie same przed i po tym samym. Ciśnienie i temperatura są ważnymi zmiennymi w zakresie ich zakwaterowania w jednej lub innej fazie. Kiedy nastąpi zmiana stanu, powstaje układ dwufazowy, złożony z tej samej materii w dwóch różnych stanach fizycznych.
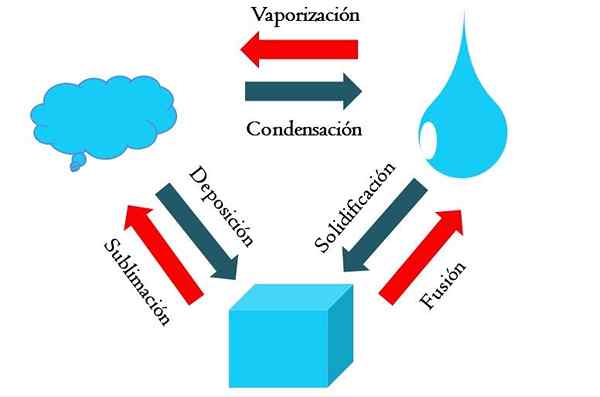
 Zmiany stanu. Źródło: Gabriel Bolívar
Zmiany stanu. Źródło: Gabriel Bolívar Wyższy obraz pokazuje główne zmiany stanu, które mają znaczenie w normalnych warunkach.
Solidna kostka niebieskawej substancji może stać się ciekłą lub gazową w zależności od temperatury i ciśnienia otoczenia. Sam w sobie reprezentuje jedną fazę: stał. Ale w czasie topnienia, to znaczy stopić równowagę stałą cieczową zwaną fuzją (ustalona jest czerwona strzałka między wiadrem a niebieską kroplą).
Aby wystąpić fuzja, kostka musi wchłonąć ciepło z otoczenia, aby zwiększyć jego temperaturę; Dlatego jest to proces endotermiczny. Gdy sześcian jest stopiony, jest to po raz kolejny pojedyncza faza: stanu ciekłego.
Ta blota może nadal pochłaniać ciepło, co zwiększa jego temperaturę i powoduje powstanie tworzenia się bąbelków gazowych. Znowu istnieją dwie fazy: jedna ciecz i druga soda. Kiedy cała ciecz wyparuje przez swoją temperaturę wrzenia, mówi się, że gotuje się lub odparowała.
Teraz niebieskawe krople zostały przekształcone w chmury. Jak dotąd wszystkie procesy były endotermiczne. Niebieskawy gaz może nadal wchłania ciepło, aż się podgrzeje; Jednak biorąc pod uwagę warunki lądowe, przeciwnie ma to przeciwnie chłodzenie i kondensowanie w cieczy (kondensacja).
Z drugiej strony chmury mogą być również zdeponowane bezpośrednio w fazie stałej, tworząc ponownie stałą kostkę (osadzanie). Te dwa ostatnie procesy są egzotermiczne (niebieskie strzałki); Oznacza to, że uwalniają ciepło do środowiska lub w okolicy.
Oprócz kondensacji i osadzania, nastąpiła zmiana stanu, gdy blota zamarza w niskich temperaturach (zestalenie).
[TOC]
Rodzaje zmian państwowych i ich cechy
Obraz pokazuje typowe zmiany dla trzech (najczęstszych) stanów materii: stałe, ciekłe i gazowe. Zmiany towarzyszące czerwone strzałki są endotermiczne, sugerują wchłanianie ciepła; Podczas gdy te towarzyszące niebieskie strzałki są egzotermiczne.
Krótki opis każdej z tych zmian zostanie dokonany poniżej, podkreślając niektóre z jego cech z rozumowania molekularnego i termodynamicznego.
- Połączenie
Fuzja to zmiana stanu substancji ze stanu stałego na ciecz.

W stanie stałym cząstki (jony, cząsteczki, klastry itp.) są „więźniami”, znajdującymi się w ustalonych pozycjach przestrzeni bez możliwości swobodnego poruszania się. Są jednak w stanie wibrować przy różnych częstotliwościach, a jeśli są one bardzo silne, rygorystyczny porządek narzucony przez siły międzycząsteczkowe zacznie się „rozpadać.
W rezultacie uzyskuje się dwie fazy: jedna, w której cząstki kontynuują ograniczone (stałe), a druga, gdzie są swobodne (cieczy), wystarczające do zwiększenia odległości, które je oddzielają od siebie. Aby to osiągnąć, ciało stałe musi wchłaniać ciepło, a zatem jego cząsteczki wibrowane będą większą siłą.
Może ci służyć: masa atomowa: definicja, typy, jak ją obliczyć, przykładyZ tego powodu fuzja jest endotermiczna, a kiedy się zaczyna, mówi się, że występuje równowaga między fazami stałymi.
Ciepło niezbędne do powstania tej zmiany nazywa się ciepłem lub entalpią topnienia (δhFus). Wyraża to ilość ciepła (energia, głównie w jednostkach KJ), która musi wchłonąć kret substancji stałej, aby się stopić, a nie po prostu podnieść jego temperatury.
Śnieżna kula
 Topnie śnieg ręką. Źródło: Pixabay
Topnie śnieg ręką. Źródło: Pixabay Mając to na uwadze, rozumiane jest, dlaczego śnieżka topi się w dłoni (obraz doskonały). Śnieg pochłania ciepło ciała, które wystarczy, aby podnieść temperaturę śniegu powyżej 0 ° C.
Kryształy lodu obecne na śniegu wchłaniają prawe ciepło do stopienia się i tak aby ich cząsteczki wody przyjmowały bardziej nieuporządkowaną strukturę. Podczas gdy śnieg się topi, utworzona woda nie zwiększy jej temperatury, ponieważ całe ciepło ręki wykorzystuje śnieg, aby zakończyć fuzję.
- Odparowanie

Waporyzacja to zmiana stanu substancji ze stanu ciekłego na gaz.
Kontynuując przykład wody, teraz umieszczając garść śniegu w garnku i zapalając ogień, obserwuje się, że śnieg szybko się topi. Gdy woda jest podgrzewana, zaczynają się tworzyć małe bąbelki dwutlenku węgla i inne możliwe zanieczyszczenia gazowe.
 Gotująca się woda. Źródło: Pixabay
Gotująca się woda. Źródło: Pixabay Ciepło rozszerzyło molekularnie nieuporządkowane konfiguracje wody, zwiększając jej objętość i zwiększając jej ciśnienie pary; Dlatego istnieje kilka cząsteczek, które uciekają z produktu powierzchniowego wzrostu parowania.
Ciekła woda powoli zwiększa swoją temperaturę ze względu na wysokie ciepło właściwe (4184J/° C ∙ g) g). Istnieje punkt, w którym ciepło, które pochłania się, nie wykorzystuje go już do podnoszenia swojej temperatury, ale do rozpoczęcia równowagi ciekłej; Oznacza to, że zaczyna się gotować, a cała ciecz przechodzi do stanu gazowego podczas pochłaniania ciepła i utrzymuje stałą temperaturę.
Tutaj obserwuje się intensywny bąbelek na powierzchni gotowanej wody (obraz doskonały). Ciepło, które pochłania ciekłą wodę, tak że ciśnienie pary jej początkowe pęcherzyki równa się ciśnieniu zewnętrznemu, nazywa się entalpią para (δHVap).
Rola presji
Presja jest również decydująca w zmianach państwowych. Jaki jest jego wpływ na parowanie? Że przy większym ciśnieniu, im większe ciepło, które musi wchłonąć wodę, a zatem jest odparowana powyżej 100 ° C.
Wynika to z faktu, że wzrost ciśnienia utrudnia ucieczkę od cząsteczek wody z fazy ciekłej do sody.
Potrawy ciśnieniowe wykorzystują ten fakt na ich korzyść do ogrzewania żywności w wodzie w temperaturze powyżej temperatury wrzenia.
Z drugiej strony, mając próżnię lub spadek ciśnienia, ciekła woda potrzebuje niższej temperatury, aby zagotować i przejść do fazy gazowej. Przy dużym lub niewielkim nacisku, w momencie gotowania wody musi wchłonąć odpowiedni ciepło parowania, aby zakończyć zmianę stanu.
- Kondensacja
Kondensacja to zmiana stanu substancji ze stanu gazowego na stan ciekł.
Może ci służyć: galaktozę
Woda odparowała. Co dalej? Para wodna może nadal zwiększyć swoją temperaturę, stając się niebezpiecznym prądem zdolnym do powodowania poważnych oparzeń.
Zamiast tego przypuśćmy, że się ochłodzi. Jak? Uwalnianie ciepła do środowiska, a po zwolnieniu ciepła mówi się, że proces egzotermiczny dzieje się.
Uwalniając ciepło, cząsteczki gazowe bardzo energetyczne zaczynają zwalniać. Ponadto jego interakcje zaczynają być bardziej skuteczne, gdy opada temperatura pary. Po pierwsze, powstają kropelki wody, kondensat parowy, a następnie powiększone krople, które kończą się przyciągnięciem grawitacji.
Aby całkowicie potwierdzić pewną ilość pary, musisz zwolnić tę samą energię, ale z przeciwnym znakiem, przy δhVap; to znaczy entalpia kondensacji δhCondc. Zatem odwrotna, równowaga pary i ciecz jest stabilna.
Zwilżone okna
 Kondensacja wody. Źródło: Pexels
Kondensacja wody. Źródło: Pexels Kondensację można zaobserwować w samych oknach gospodarstw domowych. W chłodne dni para wodna zawarta wewnątrz domu zderzy się z oknem, które przez jego materiał ma niższą temperaturę niż inne powierzchnie.
Tam łatwiej jest grupować cząsteczki pary, tworząc cienką białawą warstwę łatwo wymeldowaną ręcznie. Ponieważ te cząsteczki uwalniają ciepło (szkło grzewcze i powietrze), zaczynają tworzyć liczniejsze klastry, aż będą mogły skondensować pierwsze krople (górny obraz).
Kiedy krople znacznie zwiększają ich rozmiar, przesuwają się przez okno i zostawiają ślad wody.
- Zestalenie
Zestalenie to zmiana stanu substancji ze stanu ciekłego na stan stały.

Zestalenie występuje z powodu chłodzenia; Innymi słowy, woda zamarza. Aby zamrozić, woda musi uwolnić tę samą ilość ciepła, które pochłania lód do stopienia. Ponownie, ciepło to nazywa się zestalanie lub entalpię zamrażania, δhCong (--HHFus).
Podczas chłodzenia cząsteczki wody tracą energię, a ich interakcje międzycząsteczkowe stają się silniejsze i bardziej kierunkowe. W rezultacie są one zamawiane dzięki mostom wodorowym i tworzą SO -Calowane kryształy lodowe. Mechanizm, za pomocą którego kryształy lodu mają wpływ na ich wygląd: przezroczysty lub biały.
 Rzeźby Lodowej. Źródło: Pixabay
Rzeźby Lodowej. Źródło: Pixabay Jeśli kryształy lodu rosną bardzo powoli, nie zatrzymują one zanieczyszczeń, takich jak gazy, które w niskich temperaturach są rozpuszczone w wodzie. Zatem bąbelki uciekają i nie mogą wchodzić w interakcje ze światłem; I w konsekwencji istnieje lód tak przezroczysty, jak niezwykła posąg lodu (obraz doskonały).
To samo, co dzieje się z lodem, może się zdarzyć z każdą inną substancją, która zestala się przez chłodzenie. Być może jest to najbardziej złożona zmiana fizyczna w warunkach naziemnych, ponieważ można uzyskać kilka polimorfów.
- Sublimacja
Sublimacja to zmiana stanu substancji z stałego na gaz.

Może podlewać sublim? Nie, przynajmniej nie w normalnych warunkach (t = 25 ° C, p = 1 atm). W przypadku sublimacji występuje to zmiana stanu stałego gazu, ciśnienie pary stałego musi być wysokie.
Podobnie ważne jest, aby ich siły międzycząsteczkowe nie były bardzo silne, najlepiej, jeśli składają się tylko z sił dyspersji
Najbardziej emblematyczny przykład jest jod stały. Jest to krystaliczne stałe tonów szaro-morowych, które ma wysokie ciśnienie pary. Takie jest, że w swoim akcie następuje fioletowa opara, której objętość i ekspansja są godne uwagi, gdy jest pod ociepleniem.
Może ci służyć: trietilamina: struktura, właściwości, zastosowania i ryzyko Sublimacja jodu. Źródło: Belkina N V [CC przez 4.0 (https: // creativeCommons.Org/licencje/według/4.0)], z Wikimedia Commons
Sublimacja jodu. Źródło: Belkina N V [CC przez 4.0 (https: // creativeCommons.Org/licencje/według/4.0)], z Wikimedia Commons Na górnym obrazie pokazano typowy eksperyment, w którym stały jod paruje w szklanym pojemniku. Interesujące i uderzające jest obserwowanie, jak rozpowszechniane są purpurowe opary, a zainicjowany uczeń może zweryfikować brak płynnego jodu.
Jest to główna cecha sublimacji: nie ma obecności fazy ciekłej. Jest również endotermiczny, ponieważ ciało stałe pochłania ciepło, aby zwiększyć jego ciśnienie pary do równego ciśnienia zewnętrznego.
- Zeznanie
 Kryształowa wyludnienie. Źródło: Stanislav.Nevyhosteny [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)], z Wikimedia Commons
Kryształowa wyludnienie. Źródło: Stanislav.Nevyhosteny [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)], z Wikimedia Commons Odkładanie jest zmianą stanu substancji ze stanu gazowego na stan stały.
Równolegle do eksperymentu sublimacji jodu, masz to zeznanie. Osadzanie jest odwrotną zmianą lub przejście: substancja przechodzi ze stanu gazowego do ciała stałego bez powstawania fazy ciekłej.
Kiedy jodowe opary fioletowe zetkną się z zimną powierzchnią, uwalniają ciepło, aby je podgrzewać, tracąc energię i ponownie przegrupowując cząsteczki w szarym stałym stałym (obrazy). Jest to zatem proces egzotermiczny.
Odkładanie jest szeroko stosowane do syntezy materiałów, w których domieszkują atomy metali za pomocą wyrafinowanych technik. Jeśli powierzchnia jest bardzo zimna, wymiana ciepła między nią a cząstkami pary jest nagła, pomijając przejście przez odpowiednią fazę ciekłą.
Ciepło lub entalpia zeznań (i nie Zeznanie) jest sublimacja (δhPod=- δHD.E.P). Teoretycznie można sublimować wiele substancji, ale aby to osiągnąć, konieczne jest manipulowanie ciśnieniami i temperaturami, oprócz posiadania pod ręką schematu P vs T; w którym można wizualizować ich odległe możliwe fazy.
Inne zmiany stanu
Chociaż nie są wymienione, istnieją inne stany materii. Czasami charakteryzują się „trochę każdego”, a zatem ich kombinację. Aby je wygenerować, ciśnienia i temperatury powinny być manipulowane na bardzo pozytywne (duże) lub ujemne (małe) wielkości.
Zatem na przykład, jeśli gazy zostaną znacznie podgrzewane, stracą swoje elektronę i ich pozytywnie obciążone jądra w tym ujemnym fali stanowią tak zwaną plazmę. Jest to synonim „gazu elektrycznego”, ponieważ ma wysoką przewodność elektryczną.
Z drugiej strony, gdy temperatury są zbyt duże, materia może zachowywać się nieoczekiwanie; Oznacza to, że wykazują unikalne właściwości wokół bezwzględnego zera (0 k).
Jedną z tych właściwości jest zbędność i nadprzewodnictwo; a także tworzenie kondensatu Bose-Einsteina, w którym wszystkie atomy zachowują się jak jeden.
Nawet niektóre badania wskazują na materię fotoniczną. W nich cząstki promieniowania elektromagnetycznego, fotony, są grupowane w celu tworzenia cząsteczek fotonicznych. To znaczy, że dałaby masę niektórym ciałom światła, teoretycznie.
Bibliografia
- Helmestine, Anne Marie, pH.D. (19 listopada 2018 r.). Lista zmian fazowych między stanem materii. Odzyskane z: Thoughtco.com
- Wikipedia. (2019). Stan materii. Źródło: w:.Wikipedia.org
- Dorling Kinersley. (2007). Zmiana stanu. Odzyskane z: factmonster.com
- Meyers Ami. (2019). Zmiana fazowa: parowanie, kondensacja, powiadomienie, topnienie, sublimacja i osadzanie. Badanie. Odzyskane z: Study.com
- Bagley m. (11 kwietnia 2016). Materia: definicja i pięć stanu materii. Odzyskane z: Livescience.com
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- « Drugie prawo formuł termodynamicznych, równania, przykłady
- Struktura jodku potasu (KI), właściwości, uzyskiwanie, zastosowania, ryzyko »

