Drugie prawo formuł termodynamicznych, równania, przykłady

- 2549
- 557
- Marianna Czarnecki
Drugie prawo termodynamiki ma kilka form ekspresji. Jeden z nich stwierdza, że żadna maszyna termiczna nie jest w stanie całkowicie przekształcić całej energii, którą wchłania w użyteczną pracę (preparat Kelvin-Planck). Innym sposobem na stwierdzenie jest stwierdzenie, że rzeczywiste procesy występują w takim sensie, że jakość energii jest niższa, ponieważ Entropia To ma tendencję do wzrostu.
Prawo to, znane również jako druga zasada termodynamiki, zostało wyrażone na różne sposoby z upływem czasu, od początku XIX wieku do teraźniejszości, chociaż jego pochodzenie pochodzi z tworzenia pierwszych maszyn parowych w Anglii, Na początku XVIII wieku.
 Rysunek 1. Podczas budowania bloków konstrukcyjnych na podłogę bardzo zaskakujące byłoby uporządkowanie. Źródło: Pixabay.
Rysunek 1. Podczas budowania bloków konstrukcyjnych na podłogę bardzo zaskakujące byłoby uporządkowanie. Źródło: Pixabay. Ale chociaż jest to wyrażone na wiele sposobów, w całym pomyśle, że materia ma tendencję do zaburzenia i że nie ma 100%, ponieważ zawsze będą istnieć straty.
Wszystkie systemy termodynamiczne przylegają do tej zasady, zaczynając od samego wszechświata do filiżanki porannej kawy, która cicho czeka na stole, wymieniając ciepło ze środowiskiem.
Kawa chłodzi się w miarę upływu czasu, aż będzie w równowadze termicznej ze środowiskiem, więc byłoby bardzo zaskakujące, gdyby pewnego dnia wydarzyło się odwrotnie, a atmosfera ostygna. Jest mało prawdopodobne, że niektórzy powiedzą to niemożliwe, ale wystarczy wyobrazić sobie, aby mieć pojęcie o sensie, w którym rzeczy się dzieją spontanicznie.
W innym przykładzie, jeśli przesuniemy książkę na powierzchni stołu, ostatecznie się zatrzyma, ponieważ jego energia kinetyczna zostanie utracona w postaci ciepła z powodu tarcia.
Pierwsze i drugie prawo termodynamiki zostały ustanowione około 1850 r., Dzięki naukowcom takim jak Lord Kelvin -Creator terminu „termodynamika” -, William Rankine -autor pierwszego formalnego tekstu termodynamiki -i Rudolpha Clausiusa.
[TOC]
Wzory i równania
Entropia -bez początku -ma nam ustalenie poczucia, w którym rzeczy się dzieją. Wróćmy do przykładu ciał w kontakcie termicznym.
Kiedy dwa obiekty w różnych temperaturach są kontaktowe, a wreszcie po pewnym czasie osiągają równowagę termiczną, napędzane są do niego faktem, że entropia osiąga maksimum, gdy temperatura obu jest taka sama, jest taka sama.
Oznaczanie entropii jako S, Zmiana entropii Δs systemu jest podawane przez:

Zmiana entropii Δs Wskazuje stopień zaburzenia w systemie, ale istnieje ograniczenie w stosowaniu tego równania: ma zastosowanie tylko do procesów odwracalnych, to znaczy tych, w których system może powrócić do swojego pierwotnego stanu bez pozostawienia śladu tego, co stało się-.
W nieodwracalnych procesach drugie prawo termodynamiki przejawia się w następujący sposób:
Może ci służyć: Numer Reynoldsa: Po co to jest, jak jest obliczane, ćwiczenia
Odwracalne i nieodwracalne procesy
Puchar kawy zawsze chłodzi i jest dobrym przykładem nieodwracalnego procesu, ponieważ zawsze występuje w jednym kierunku. Jeśli do kawy zostanie dodany krem do kawy i zamieszaj, zostanie uzyskana bardzo przyjemna kombinacja, ale bez względu na to, jak znów mieszając, kawa i krem nie będą ponownie, ponieważ mieszanie jest nieodwracalne.
 Rysunek 2. Pękanie kubka to nieodwracalny proces. Źródło: Pixabay.
Rysunek 2. Pękanie kubka to nieodwracalny proces. Źródło: Pixabay. Chociaż większość codziennych procesów jest nieodwracalna, niektóre są prawie Odwracalny. Odwracalność jest idealizacją. Do przeprowadzenia system musi się zmieniać bardzo powoli, aby w każdym punkcie zawsze był w równowadze. W ten sposób możliwe jest zwrócenie go do poprzedniego stanu bez pozostawienia śladu.
Procesy, które są dość zbliżone do tego ideału, są bardziej wydajne, ponieważ zapewniają większą pracę przy mniejszym zużyciu energii.
Siła tarcia jest odpowiedzialna za większość nieodwracalności, ponieważ ciepło wytwarzane przez nią nie jest rodzajem dążenia do energii. W książce przesuwającej się po stole, ciepło po tarciu jest energią, która nie jest odzyskana.
Chociaż książka powraca do swojej pierwotnej pozycji, stół będzie gorący jako ślad przychodzenia i wychodzenia.
Obserwuj teraz żarówkę: Większość prac wykonanych przez prąd, który przekracza włókno, jest marnowana w cieple przez efekt Joule. Tylko niewielki procent służy do emisji światła. W obu procesach (książka i żarówka) entropia systemu wzrosła.
Aplikacje
Idealny silnik to ten, który jest zbudowany przez odwracalne procesy i nie ma tarcia, które powodują odpady energetyczne, obracając prawie Cała energia cieplna w użytecznej pracy.
Podkreślaliśmy to słowo, ponieważ nawet idealny silnik, który jest Carnota, ma 100% wydajności. Drugie prawo termodynamiki nie jest w ten sposób.
Silnik Carnot
Silnik Carnota to najbardziej wydajny silnik, który można opracować. Działa między dwoma złożami temperatury w dwóch procesach izotermicznych - w stałej temperaturze - a dwoma procesami adiabatycznymi - bez transferu energii cieplnej-.
Wykresy zwane diagramami ciśnienia PV - objętość - wyjaśniają sytuację:
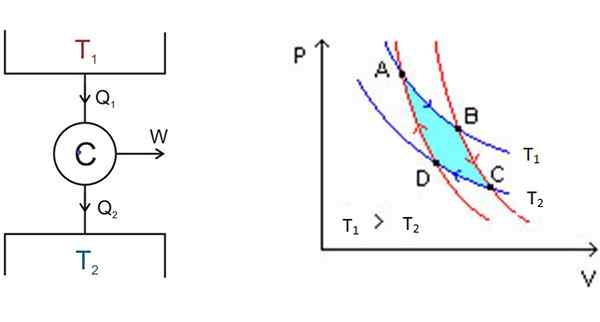 Rysunek 3. Po lewej stronie schemat silnika Carnot i po prawej schemacie P-V. Źródło: Wikimedia Commons.
Rysunek 3. Po lewej stronie schemat silnika Carnot i po prawej schemacie P-V. Źródło: Wikimedia Commons. Po lewej stronie na rycinie 3 znajduje się schemat motoryczny Carnot C, który przyjmuje ciepło Q1 złoża w temperaturze t1, Przekształć to ciepło w pracę w marnotrawstwo2 do najzimniejszego złoża, który jest w temperaturze t2.
Począwszy od A, system się rozszerza, aż osiągnie B, pochłaniając ciepło do stałej temperatury t1. W B system rozpoczyna rozszerzenie adiabatyczne, w którym ciepło nie jest wygrane ani utracone, aby dostać się do C.
W C zaczyna się inny proces izotermiczny: nadać ciepło innym chłodniejszym złożeniu termicznym, który jest w t2. Jak to się zdarza, system jest ściśnięty i osiągany jest punkt D. Tam rozpoczyna drugi proces adiabatyczny, aby powrócić do punktu początkowego. W ten sposób cykl jest zakończony.
Może ci służyć: przenoszenie ciepła przez jazdę (z przykładami)Wydajność Carnota zależy od temperatur w Kelvin od dwóch złóż termicznych:
Maksymalna wydajność = (qwejście - QWyjście) /Qwejście = 1 - (t2/T1)
Twierdzenie Carnota stwierdza, że jest to najbardziej wydajna maszyna termiczna, ale nie spiesz się, aby go kupić. Czy pamiętasz, co powiedzieliśmy o odwracalności procesów? Muszą się zdarzyć bardzo, bardzo powoli, więc moc wyjściowa tego urządzenia jest praktycznie zerowa.
Ludzki metabolizm
Ludzie potrzebują energii, aby utrzymać wszystkie swoje systemy, dlatego zachowują się jak maszyny termiczne, które otrzymują energię i przekształcają ją w energię mechaniczną, aby na przykład poruszać.
Efektywność I ludzkiego ciała podczas wykonywania pracy można zdefiniować jako stosunek między mocą mechaniczną, jaką może zapewnić, a całkowite wejście energii, które są wyposażone w żywność.
Jak średnia moc pM Jest to praca wykonana w przedziale czasowym Δt, Można to wyrazić jako:
PM = W/δt
Tak Δu/δt Jest to szybkość dodawania energii, pozostaje wydajność ciała:

Dzięki licznym testom z wolontariuszami uzyskano wydajność nawet 17%, dostarczając około 100 watów mocy przez kilka godzin.
Oczywiście będzie to w dużej mierze zależeć od wykonanego zadania. Pedalowanie roweru ma nieco większą wydajność, około 19 %, podczas gdy powtarzające się zadania obejmujące ostrza, szczyty i motyki mają wydajność tak niską, jak około 3 %.
Przykłady
Drugie prawo termodynamiki jest ukryte we wszystkich procesach występujących we wszechświecie. Entropia zawsze rośnie, chociaż w niektórych systemach wydaje się, że zmniejsza. Aby to wzrosło gdzie indziej, tak że w całkowitej równowadze jest to dodatnie.
- Na uczeniu się jest entropia. Są ludzie, którzy uczą się rzeczy dobrze i szybko, oprócz tego, że mogą je łatwo zapamiętać. Mówi się, że są to ludzie o niskiej uczeniu się entropii, ale z pewnością są mniej liczne niż osoby o wysokiej entropii: ci, którzy najwięcej pamiętają rzeczy, które studiują.
- Firma z zdezorganizowanymi pracownikami ma więcej entropii niż taka, w której pracownicy wykonują zadania w uporządkowany sposób. Oczywiste jest, że ten ostatni będzie bardziej wydajny niż pierwszy.
- Siły tarcia generują mniejszą wydajność w funkcjonowaniu maszyn, ponieważ zwiększają ilość rozproszonej energii, której nie można skutecznie wykorzystać.
- Uruchomienie kości ma większą entropię niż wyrzucenie monety w powietrze. W końcu uruchomienie waluty ma tylko 2 możliwe wyniki, podczas gdy uruchomienie kości wynosi 6. Im więcej wydarzeń jest prawdopodobne, tym więcej entropii istnieje.
Może ci służyć: jakie są elementy ruchu?Rozwiązane ćwiczenia
Ćwiczenie 1
Cylinder z tłokiem jest wypełniony mieszaniną płynnej i wodnej pary przy 300 K, a 750 kJ ciepła jest przenoszony do procesu stałego ciśnienia. W rezultacie ciecz wewnątrz cylindra jest odparowana. Oblicz zmianę entropii w tym procesie.
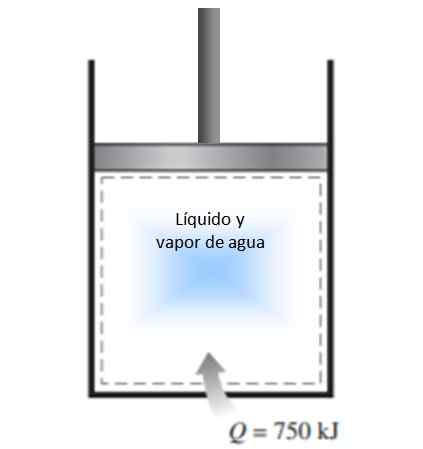 Rysunek 4. Rysunek dla przykładu rozwiązanego 1. Źródło: f. Zapata.
Rysunek 4. Rysunek dla przykładu rozwiązanego 1. Źródło: f. Zapata. Rozwiązanie
Proces opisany w stwierdzeniu jest przeprowadzany pod stałym ciśnieniem w zamkniętym systemie, który nie doświadcza wymiany masowej.
Ponieważ jest to para waporyzacji, podczas której temperatura się nie zmienia (podczas zmian fazy temperatura jest stała), można zastosować definicję zmiany entropii podanej powyżej, a temperatura może pominąć całkę:

ΔS = 750.000 J / 300 K = 2500 J / k.
Ponieważ system przychodzi do systemu, zmiana entropii jest pozytywna.
Ćwiczenie 2
Gaz cierpi na wzrost ciśnienia 2.00 do 6.00 Atmosfery (ATM), utrzymując stałą objętość 1.00 m3, a następnie rozwinąć stałe ciśnienie, aż osiągnie objętość 3.00 m3. Wreszcie wróć do stanu początkowego. Oblicz, ile pracy jest przeprowadzane w 1 cyklu.
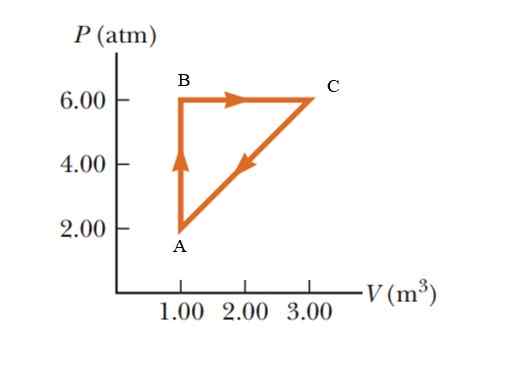 Rysunek 5. Proces termodynamiczny w gazie na przykład 2. Źródło: serwagy -vulle. Podstawy fizyki.
Rysunek 5. Proces termodynamiczny w gazie na przykład 2. Źródło: serwagy -vulle. Podstawy fizyki. Rozwiązanie
Jest to cykliczny proces, w którym wewnętrzna zmiana energii jest nieważna, zgodnie z pierwszym prawem termodynamiki, a zatem q = w. Na schemacie p -V (ciśnienie - objętość) praca wykonana podczas cyklicznego procesu jest równoważna obszarowi zablokowanemu przez krzywą. Aby dać wyniki w systemie międzynarodowym, konieczne jest zmiana jednostek w presji za pomocą następującego współczynnika konwersji:
1 atm = 101.325 kPa = 101.325 Pa.
Obszar zamknięty przez wykres odpowiada obszarowi trójkąta, którego podstawa (3 - 1 m3) = 2 m3 i którego wysokość to (6 - 2 atm) = 4 atm = 405.300 pa
WAbca = ½ (2 m3 x 405300 PA) = 405300 J = 405.3 kJ.
Ćwiczenie 3
Mówi się, że jedną z najbardziej wydajnych maszyn, które zostały zbudowane, jest turbina parowa napędzana węglem na rzece Ohio, która służy do napędzania generatora elektrycznego działającego między 1870 a 430 ° C.
Oblicz: a) maksymalna wydajność teoretyczna, b) moc mechaniczna dostarczana przez maszynę, jeśli jest pochłonięta 1.40 x 105 J energii co sekundę z gorącego zbiornika. Wiadomo, że prawdziwa wydajność wynosi 42.0%.
Rozwiązanie
a) Maksymalna wydajność jest obliczana za pomocą powyższego równania:
Maksymalna wydajność = (qwejście - Q Wyjście) /Qwejście = 1 - (t2/T1)
Aby przekazać Celsjusza Kelvinowi, wystarczy dodać 273.15 W temperaturze Celsjusza:
Mnożenie przez 100% masz maksymalną wydajność procentową, która wynosi 67.2%
c) Jeśli rzeczywistą wydajność wynosi 42%, istnieje maksymalna wydajność 0.42.
Dostarczona moc mechaniczna to: p = 0.42 x 1.40 x10 5 J/s = 58800 w.
Bibliografia
- Bauer, w. 2011. Fizyka inżynierii i nauki. Tom 1. MC Graw Hill.
- Cengel i. 2012. Termodynamika. 7mama Wydanie. McGraw Hill.
- Figueroa, zm. (2005). Seria: Fizyka nauk i inżynierii. Tom 4. Płyny i termodynamika. Pod redakcją Douglas Figueroa (USB).
- Knight, r. 2017. Fizyka dla naukowców i inżynierii: podejście strategiczne.
- López, c. Pierwsze prawo termodynamiki. Odzyskane z: cultureacientafica.com.
- Serway, r. 2011. Podstawy fizyki. 9na Cengage Learning.
- Uniwersytet Sevilla. Maszyny termiczne. Odzyskany z: Laplace.nas.Jest


=0.672)