Struktura tlenku fosforu (V), właściwości, uzyskiwanie, zastosowania, ryzyko

- 4197
- 287
- Pani Waleria Marek
On Tlenek fosforu (v) Jest to nieorganiczna substancja stała utworzona przez fosfor (p) i tlen (O). Jego empiryczna formuła to P2ALBO5, podczas gdy jego prawidłowa wzór molekularny to P4ALBO10. Jest to bardzo higroskopijna biała stała, to znaczy, że może bardzo łatwo wchłaniać powietrze z powietrza, natychmiast reagując z tym. Reakcja może być niebezpieczna, ponieważ powoduje szybki wzrost temperatury.
Jego wysoka tendencja do wchłaniania wody spowodowała, że była stosowana jako środek suszenia w laboratoriach chemicznych, a także odwodnienie niektórych związków, to znaczy eliminowania wody z jej cząsteczek.
 Tlenek fosforu (v) proszek, p4ALBO10. Lhchem [CC BY-S (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons.
Tlenek fosforu (v) proszek, p4ALBO10. Lhchem [CC BY-S (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons. Tlenek fosforu (V) jest również stosowany do przyspieszenia reakcji wiązania cząsteczek różnych węglowodorów, co jest reakcją zwaną kondensacją. Ponadto pozwala przekształcić niektóre kwasy organiczne w estry.
Zastosowano na przykład do udoskonalenia benzyny, do przygotowania kwasu fosforowego H3PO4, W celu uzyskania związków, które służą do opóźnienia pożaru, produkcji szkła do zastosowań próżniowych, wśród wielu innych zastosowań.
Tlenek fosforu (V) należy przechowywać w dobrze zamkniętych pojemnikach, aby zapobiec kontaktowi z wilgocią z powietrza. Jest żrący i może szkodzić oczu, skórze i śluzu.
[TOC]
Struktura
Tlenek fosforu (V) powstaje przez fosfor (P) i tlen (O), gdzie fosfor ma wartościowość +5 i tlenu -2. Cząsteczka tlenku fosforu (V) ma cztery fosfor i dziesięć atomów tlenu i dlatego jego prawidłowa wzór cząsteczkowy wynosi p4ALBO10.
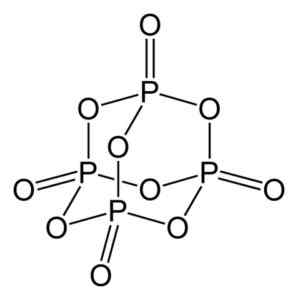 Struktura cząsteczki tlenku fosforu (V), p4ALBO10. Autor: Benjah-BMM27. Źródło: Wikimedia Commons.
Struktura cząsteczki tlenku fosforu (V), p4ALBO10. Autor: Benjah-BMM27. Źródło: Wikimedia Commons. Istnieje w trzech krystalicznych postaciach, takich jak amorficzny kurz i w szklistej postaci (jak szkło). W sześciokątnej postaci krystalicznej każda z atomów fosforu znajduje się w wierzchołkach czworościanu.
Nomenklatura
- Tlenek fosforu (v)
- Pentlenek fosforu
- Pentlenek dyphosfack
Może ci służyć: rozpuszczalnik: koncepcja, typy i przykłady- Fosforowy pentlenek
- Bezwodek fosforowy
- Rozpad tetrafosforu
Nieruchomości
Stan fizyczny
Krystaliczna biała stała. Najczęstszą formą jest kryształy sześciokątne.
Waga molekularna
283,89 g/mol
Temperatura topnienia
562 ° C
Temperatura sublimacji
Atmosfera ciśnienia 360 ° C do 1. Oznacza to, że w tej temperaturze przechodzi z litego gazu bez przechodzenia przez stan cieczy.
Gęstość
2,30 g/cm3
Rozpuszczalność
Bardzo rozpuszczalny w wodzie. Kwas siarkowy rozpuszczalny. Nierozpuszczalne w acetonie i amoniaku.
Właściwości chemiczne
Tlenek fosforu (V) wchłania i reaguje z powietrzem z powietrza o ekstremalnym szybko tworzącym kwas fosforowy H3PO4. Ta reakcja jest egzotermiczna, co oznacza, że ciepło jest wytwarzane w tym samym.
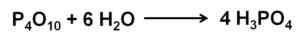 Reakcja tlenku fosforu (V) z wodą z wytworzeniem kwasu fosforowego H3PO4. Autor: Marilú Stea.
Reakcja tlenku fosforu (V) z wodą z wytworzeniem kwasu fosforowego H3PO4. Autor: Marilú Stea. Reakcja p4ALBO10 z wodą prowadzi do tworzenia mieszaniny kwasów fosforowych, których skład zależy od ilości wody i warunków.
Reakcja z alkoholem prowadzi do tworzenia kwasu fosforowego lub estrów kwasu polimerycznego w zależności od warunków eksperymentalnych.
P4ALBO10 + 6 ROH → 2 (RO)2PO.Oh + 2 ro.Puchatek)2
Z podstawowymi tlenkami tworzą fosforany stałe.
To jest żrące. Może niebezpiecznie reagować z kwasem mrówkowym i zasadami nieorganicznymi, takimi jak wodorotlenek sodu (NaOH), tlenek wapnia (CAO) lub węglan sodu Na2WSPÓŁ3.
Jeśli wyleje się roztwór kwasu kwlorycznego HCLO4 i chloroform chcl3 W tlenku fosforu (v) p4ALBO10 Występuje gwałtowna eksplozja.
Inne właściwości
To nie jest łatwopalne. Nie faworyzuje spalania. Jednak jego reakcja wody jest tak gwałtowna i egzotermiczna, że może istnieć ryzyko pożaru.
Uzyskanie
Można go przygotować przez bezpośrednie utlenianie fosforu w prądzie suchego powietrza. Fosfor, gdy kontakt nadmiar tlenu jest utleniany tworząc tlenek fosforu (V).
P4 + 5 o2 → p4ALBO10
Obecność w naturze
Tlenek fosforu (V) występuje w minerałach, takich jak ilmenit, rutilo i cyrkón.
Może ci służyć: jakie są nieorganiczne funkcje chemiczne?Ilmenit jest minerałem zawierającym żelazo i tytan, a czasem ma tlenek fosforu (V) w stężeniach, które wahają się od 0,04 do 0,33% w wysokości. Rutilo to minerał tlenku tytanu i może zawierać około 0,02% masy p2ALBO5.
Piaski Ziród (minerał elementu cyrkonu) mają tlenek fosforu (V) na poziomie 0,05-0,39%.
Aplikacje
Jako środek odwodniony i sekundowy
Ze względu na wielką awidność wody jest jednym z najbardziej znanych i bardzo skutecznych środków odwodniowych w temperaturach mniejszych niż 100 ° C.
Może wydobywać wodę z substancji, które są uważane za środki odwodniające. Na przykład możesz usunąć wodę z kwasu siarkowego H2południowy zachód4 Tak, tak3 i kwas azotowy HNO3 Zamień go w n2ALBO5.
 Odwodnienie kwasu siarkowego z powodu tlenku fosforu (V). Autor: Marilú Stea.
Odwodnienie kwasu siarkowego z powodu tlenku fosforu (V). Autor: Marilú Stea. Zasadniczo może wysuszyć wszystkie te ciecze i gazy, z którymi nie reaguje, więc pozwala usunąć ślady wilgoci z systemów próżniowych.
W reakcjach chemii organicznej
Tlenek fosforu (V) służy do zamykania pierścieni złożonych organicznych i innych reakcji kondensacji.
Pozwala steryfikować kwasy organiczne z możliwością rozróżnienia pierwotnych alifatycznych kwasów karboksylowych (łańcuch gazowany bez pierścieni z grupą -cooh na jednym końcu) i kwasów aromatycznych (grupa -coh połączona z pierścieniem benzenowym), ponieważ te ostatnie nie reagują.
Służy również do wyeliminowania cząsteczki H2Lub amidas r (c = o) nh2 I to sprawia, że nitryle r-cn. Ponadto katalizuje lub przyspiesza utlenianie, odwodornienie i polimeryzację reakcji bitumu.
 P4ALBO10 Jest szeroko stosowany w laboratoriach chemii organicznej. Autor: JDN2001CN0. Źródło: Pixabay.
P4ALBO10 Jest szeroko stosowany w laboratoriach chemii organicznej. Autor: JDN2001CN0. Źródło: Pixabay. W rafinacji paliwa
Od lat 30. XX wieku pewne badania wskazały, że tlenek fosforu (v) wywierał działanie rafinacji gazu, zwiększając oktanowy.
Działanie rafinacyjne P4ALBO10 Wynika to głównie z reakcji kondensacji (połączenie różnych cząsteczek) i nie polimeryzacji (wiązanie równych cząsteczek).
Może ci służyć: octan sodu: struktura, właściwości, synteza, zastosowaniaP4ALBO10 Przyspiesza bezpośrednie węglowodory alomatyczne za pomocą węglowodorów olefinowych, konwersją olefiny na benzyny i częściową polimeryzację. Reakcja alkilowania zwiększa liczbę oktanową benzyny.
W ten sposób uzyskuje się wysokiej jakości wyrafinowaną benzynę.
 Niektóre pochodne oleju można poprawić poprzez działanie P4ALBO10 W swoich cząsteczkach. Autor: DRPEPERSCOTT230. Źródło: Pixabay.
Niektóre pochodne oleju można poprawić poprzez działanie P4ALBO10 W swoich cząsteczkach. Autor: DRPEPERSCOTT230. Źródło: Pixabay. W różnych aplikacjach
Tlenek fosforu (V) serwuje:
- Przygotuj kwas fosforowy H3PO4
- Uzyskaj akrylan i estry środków powierzchniowo czynnych
- Przygotuj estry fosforanowe stosowane jako opóźniacze płomienia, rozpuszczalniki i rozcieńczenia
- Konwersja fosforu trichlorek do oksychlorku fosforu
- Odczynnik laboratoryjny
- Produkcja specjalnych okularów na rurki próżniowe
- Zwiększ asfalt punkt topnienia
- Służyć jako standardowa cząsteczka w oznaczaniu fosforu lub fosforanów w skale fosfatycznej, nawozach i cementu portlandzkim, w postaci p2ALBO5
- Popraw powiązania między niektórymi polimerami a warstwą kości słoniowej, którą posiadają zęby
 Niektóre specjalne okulary, takie jak rurki próżniowe, muszą użyć P4ALBO10 podczas jego produkcji. Tvezymer [domena publiczna]. Źródło: Wikimedia Commons.
Niektóre specjalne okulary, takie jak rurki próżniowe, muszą użyć P4ALBO10 podczas jego produkcji. Tvezymer [domena publiczna]. Źródło: Wikimedia Commons. Ryzyko
Tlenek fosforu (V) musi być utrzymywany w zamkniętych pojemnikach oraz w świeżo, suchych i dobrze wentylowanych miejscach.
Służy to, aby nie kontaktować się z wodą, ponieważ może ją gwałtownie reagować, wytwarzając bardzo ciepło, do punktu spalania pobliskich materiałów, które są palne.
Pył tlenku fosforu (V) jest podrażniający oko i dróg oddechowy i żrący dla skóry. Może wytwarzać oparzenia w oczach. Przez spożycie powoduje śmiertelne oparzenia wewnętrzne.
Bibliografia
- LUB.S. National Library of Medicine. (2019). Bezwodek fosforowy. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Nayler, s. 1. (2001). Astrumumeny: zmodyfikowane. Modyfikacja chemiczna. W Encyclopedia of Materials: Science and Technology. Odzyskane z naukowym.com.
- Malishev, ur.W. (1936). Pentlenek fosforu jako środek rafinacyjny dla benzyny. Chemia przemysłowa i inżynierska 1936, 28, 2, 190–193. Odzyskane z pubów.ACS.org.
- Epps, Jr. I.DO. (1950). Fotometryczne oznaczanie dostępnego pentoksydu fosforu w nawozach. Analytical Chemistry 1950, 22, 8, 1062-1063. Odzyskane z pubów.ACS.org.
- Banerjee, a. i in. (1983). Zastosowanie fosforu pentoksydu: estryfikacja kwasów organicznych. J. Org. Chem. 1983, 48, 3108-3109. Odzyskane z pubów.ACS.org.
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Kirk-Othmer (1994). Encyklopedia technologii chemicznej. Czwarta edycja. John Wiley & Sons.
- Ogliari, f.DO. i in. (2008). Synteza monomerów fosforanowych i wiązanie z zębiną: metody estryfikacji i zastosowanie fosforu pentoksydu. Journal of Dentistry, tom 36, wydanie 3, marzec 2008, strony 171-177. Odzyskane z naukowym.com.
- « Aluminiowy octan (AL (CH3CO) 3) Struktura, właściwości, używa
- Notacja opracowała to, co jest, przykłady i ćwiczenia »

