Struktura tlenku baru (BAO), właściwości, zastosowania, ryzyko

- 749
- 193
- Filip Augustyn
On Tlenek baru Jest to nieorganiczna substancja stała utworzona przez atom barowy (BA) i atom tlenu (O). Jego formuła chemiczna to bao. Jest białą krystaliczną stałą i jest higroskopijna, to znaczy pochłania wilgoć powietrza, ale czyniąc to, reaguje z tym.
Szybka reakcja tlenku baru z wodą powoduje, że jest stosowany w laboratoriach analizy chemicznej, to znaczy eliminowanie wody z rozpuszczalników organicznych, które są związkami ciekłymi, które służą do rozpuszczenia innych substancji.
 Stały tlenek baru bao. LEM [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons.
Stały tlenek baru bao. LEM [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons. Bao zachowuje się jak silna baza, dlatego reaguje z wieloma rodzajami kwasów. Na przykład reaguj łatwo z dwutlenkiem węgla2 powietrza z tworzeniem węglanu barowego Bachusa3.
Służy w produkcji polimerów do kabli energii elektrycznej i jako składnik żywic do uszczelnienia otworów zębów.
Tlenek baru (BAO) jest również stosowany w przemyśle ceramicznym, zarówno do pokrycia go szkliwem, jak i do produkcji. Jest również stosowany w mieszaninach cementowych w celu zwiększenia odporności na kompresję produktu końcowego.
[TOC]
Struktura
Tlenek Bao Baar jest tworzony przez kation BA2+ i anion tlenu lub2-.
 Jony tlenku baru bao. Autor: Marilú Stea.
Jony tlenku baru bao. Autor: Marilú Stea. W swoich kryształach Bao tworzy sześcienne sieci jonowe (w postaci sześcianu) typu chlorku sodu.
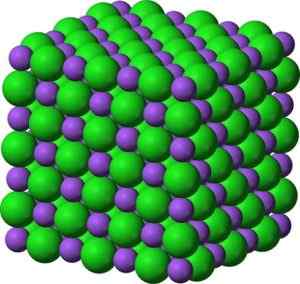 BAO BARium w kształcie krystalicznej struktury w kształcie tlenku baru podobna do chlorku sodu. Zielony: bar. Niebieski: tlen. Benjah-BMM27 (Talk · Wpiss) [domena publiczna]. Źródło: Wikimedia Commons.
BAO BARium w kształcie krystalicznej struktury w kształcie tlenku baru podobna do chlorku sodu. Zielony: bar. Niebieski: tlen. Benjah-BMM27 (Talk · Wpiss) [domena publiczna]. Źródło: Wikimedia Commons. Konfiguracja elektroniczna jonu barowego wynosi: [Xe] 6s0 Cóż, dwa elektrony warstwy 6S straciły. Ta konfiguracja jest bardzo stabilna.
Nomenklatura
-Tlenek baru
-Tlenek baru
Może ci służyć: test: cechy, typy, przykłady zastosowańWłaściwości fizyczne
Stan fizyczny
Żółtawo biały krystaliczny stał.
Waga molekularna
153,33 g/mol
Temperatura topnienia
1923 ºC
Punkt wrzenia
Około 2000 ° C.
Gęstość
5,72 g/cm3
Rozpuszczalność
Mała rozpuszczalna w wodzie: 3,8 g/100 ml w 20 ° C.
Właściwości chemiczne
Bario Bao Tlenek reaguje szybko2, który jest najbardziej rozpuszczalnym wodorotlenkiem między alkalineterical hydroksydami metali.
Bao + h2O → Ba (OH)2
Bao to silna baza. Reaguje egzotermiczne (to znaczy w przypadku oddziału cieplnego) ze wszystkimi rodzajami kwasów.
Z co2 Bao reaguje, tworząc węglan barowy Bachus3.
Bao + co2 → Bacchus3
Bao jest higroskopijny, ponieważ jeśli jest dozwolone dla środowiska, stopniowo łączy się z wilgocią powietrza, tworząc BA (OH)2 który jest w połączeniu z dwutlenkiem węgla2 powietrza, które daje bachus węglanowy baru3.
Gdy tlenek baru baru Bao jest ogrzewany w obecności powietrza, łączy się on z tlenem nadtlenkiem baru Bao2. Reakcja jest odwracalna.
2 bao + o2 ⇔ 2 bao2
W obecności wody może reagować z aluminium na lub z FIFC Zn, tworząc tlenki lub wodorotlenki tych metali i wytwarzając Hydrogen GAS H2.
Możesz zainicjować polimeryzację związków organicznych, które można polimeryzować, takie jak epoksydy.
Ryzyko
Może być toksyczne przez spożycie. Nie powinieneś kontaktować się ze skórą. To drażniące oczy, skóra i dróg oddechowy. Może być szkodliwy dla układu nerwowego. Jest w stanie powodować niski poziom potasu, co powoduje zaburzenia serca i mięśni.
Uzyskanie
Tlenek baru bao można uzyskać przez podgrzewanie węglanu Bacio Baco3 Z węglem. BAO powstaje i uwalnia się gaz tlenku węgla.
Bachus3 + C → Bao + 2 CO ↑
Aplikacje
Jako wysyłanie rozpuszczalników organicznych
Ze względu na łatwość reakcji z wodą, Bao był używany od połowy ubiegłego wieku jako wysuszony dla benzyny i podstawowych rozpuszczalników organicznych.
Może ci służyć: kwas cyjanhydowy: struktura molekularna, właściwości, zastosowaniaBAO jest bardzo aktywnie wysycha wokół niego, bardzo szybko wymaga wilgoci, z ewolucją całkiem ciepła, tworzących wodorotlenek barowy BA (OH)2 który jest stabilny do około 1000 ° C. Dlatego bao może być stosowane w wysokich temperaturach.
Ma również wysoką zdolność absorpcji wody. Dla każdej cząsteczki Bao można wchłonąć wodę i Ba (OH)2 W rezultacie może również pochłonąć pewną ilość wody.
Nadaje się do laboratoriów chemii analitycznej. To nie jest lepkie.
Może być stosowany w wysuszach, które są dużymi szklanymi pojemnikami z pokrywką, w której utrzymywana jest sucha atmosfera wewnętrzna. Bao utrzymuje suchy miniatmosfera wysusznika.
 Odległości w laboratorium. Szybka stała, taka jak bao, jest umieszczana na dnie podstawy. Oryginalnym przesyłaczem był Rifleman 82 w angielskiej Wikipedii. [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]]. Źródło: Wikimedia Commons.
Odległości w laboratorium. Szybka stała, taka jak bao, jest umieszczana na dnie podstawy. Oryginalnym przesyłaczem był Rifleman 82 w angielskiej Wikipedii. [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]]. Źródło: Wikimedia Commons. Te wysuszniki służą do umieszczania substancji lub odczynników, a tym samym uniemożliwiają im wchłanianie wody ze środowiska.
Służy również do wysuszenia podstawowych gazów, takich jak amoniak NH3.
W lampach do pobrania
BAO umieszcza się w elektrodach lamp wyładowczych jako materiał emitujący elektron.
Lampy wyładowcze są tworzone przez szklaną rurkę, kwarc lub inny odpowiedni materiał, zawierają gaz obojętny, a w większości przypadków metalowy para. Metalowa para może być sod lub rtęć.
 Lampa rtęci. Dmitriry G [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons.
Lampa rtęci. Dmitriry G [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons. Wewnątrz rurki występuje porażenie elektryczne, ponieważ ma elektrodę dodatnią i ujemną.
Bao jest umieszczany w elektrodach lampowych. Emitowane elektrony zderzają się z metalowymi atomami pary i przesyła energię.
Może ci służyć: tlenku miedzi (CUO)Podczas przepuszczania prądu elektrycznego przez ten gaz lub pary występuje światło widzialne lub promieniowanie ultrafioletowe (UV).
W produkcji ceramicznej
BAO jest stosowany w szklonych kompozycjach powłokowych ceramicznych.
 Powlekana fasada z glazurowaną ceramiką. Penny Mayes/Glazed Feçade. Źródło: Wikimedia Commons.
Powlekana fasada z glazurowaną ceramiką. Penny Mayes/Glazed Feçade. Źródło: Wikimedia Commons. Jednak został również przetestowany jako dodatek w przygotowaniu HOB.
BAO skutecznie poprawia cechy mechaniczne i odporność chemiczną tego rodzaju ceramiki. Ma silny wpływ na właściwości termiczne i skład fazy krystalicznej uzyskanych materiałów.
W przygotowaniu mieszanin cementowych
BAO został przetestowany jako składnik cementu fosfoalumination.
Ten rodzaj cementu jest przydatny w środowiskach morskich, ponieważ nie ma takiej samej tendencji do nawadniania jak inne rodzaje cementu, więc nie cierpi na pory lub ekspansję.
Jednak cementy z fosfoaluminacji muszą być wzmocnione w ich wydajności mechanicznej, aby móc wytrzymać prądy morskie i ciosy pływających kawałków lodu obecnego w oceanie.
Dodanie BAO do cementu fosfoalizacji modyfikuje strukturę mineralną wspomnianego materiału, poprawia strukturę porów i znacznie zwiększa siłę ściskającą pasty cementowej.
Innymi słowy, Bao poprawia odporność na kompresję tego rodzaju cementu.
 Mieszaj do betonu. Tlenek baru bao jest przydatny do poprawy niektórych właściwości cementu. Thamizhpparithi Maari [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons.
Mieszaj do betonu. Tlenek baru bao jest przydatny do poprawy niektórych właściwości cementu. Thamizhpparithi Maari [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons. W kilku aplikacjach
Jest używany jako składnik zapewniający krycie w żywicach dentystycznych do wypełniania otworów w zębach, wykonywanych przez dentystów.
Jest również stosowany jako środek zarodkowania do przygotowania polimerów fluorku poliwinylidenu, które są używane do izolowania kabli elektrycznych.
Bibliografia
- Partyka, J. i in. (2016). Wpływ dodania BAO na spiekanie materiałów szklanych z ceramicznych z SIO2-Do2ALBO3-Na2DOBRA2System O-CAO/MGO. J Therm Anal Calim (2016) 125: 1095. Link odzyskał.Skoczek.com.
- Zhang, s. 1. i in. (2019). Wpływ BAO na strukturę minerałów i zachowanie nawodnienia cementu fosfoaluminacu. J Therm Anal Calim (2019) 136: 2319. Link odzyskał.Skoczek.com.
- LUB.S. National Library of Medicine. (2019). Barium tlenku. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Smith, n.DO. (2003). Oświetlenie. Zasada. W książce referencyjnej Electrical Engineer (wydanie Sixteenth). Odzyskane z naukowym.com.
- Ebnejjad, s. (2003). Piany fluoropolimerowe. PVDF Piadanie. W stopionym fluoroplastyce. Odzyskane z naukowym.com.
- Booth, h.S. i McIntyre, L.H. (1930). Tlenek baru jako wysyłka. Ind. Eng. Chem. Analny. Wyd. 1930, 2, 1, 12-15. Odzyskane z pubów.ACS.org.
- « Struktura cyjanku sodu (NACN), właściwości, ryzyko, używa
- 15 najlepszych potraw do zwiększenia pośladków (naturalnych) »

