Struktura cyjanku sodu (NACN), właściwości, ryzyko, używa

- 4840
- 24
- Pani Waleria Marek
On Cyjanek sodowy Jest to sól nieorganiczna utworzona przez kation sodu+ i cyjankowy anion CN-. Jego wzór chemiczny jest nacn. Znany również jako cyjanku sodu, jest to biała krystaliczna substancja stała. Jest higroskopijny, to znaczy pochłania wodę ze środowiska, a jego kryształy są sześcienne, takie jak chlorek sodu.
Podczas rozpuszczania się w wodzie ma tendencję do tworzenia cyjanku wodoru HCN. Jego rozwiązania łatwo rozpuszczają złoto i srebro. Ta funkcja sprawia, że jest używany do wydobywania złota i srebra z minerałów. Rozwiązania użyte w tym celu są poddane recyklingowi, to znaczy są ponownie wykorzystywane kilka razy.
 Cyjanek sodu sodu. L26 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons.
Cyjanek sodu sodu. L26 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons. Jednak niektórym cyjanku udaje się uciec od niektórych stawów odpadowych, które stanowi zagrożenie dla fauny i istoty ludzkiej, ponieważ cyjanek jest bardzo toksyczny i może powodować śmierć.
NACN jest stosowany w przemyśle chemicznym jako pośrednik do przygotowania kilku rodzajów związków, takich jak barwniki, chemikalia dla rolnictwa i leków lub leków.
Cyjanku sodu jest bardzo niebezpiecznym związkiem, ponieważ może powodować śmierć, więc należy go zmanipulować z ekstremalną ostrożnością.
[TOC]
Struktura
Cyjanku sodu jest tworzone przez jonowe na+ i jonowe cn-.
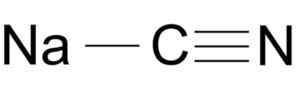 Struktura cząsteczki cyjanku sodu nacn. Arrowsmaster [domena publiczna], źródło: Wikimedia Commons.
Struktura cząsteczki cyjanku sodu nacn. Arrowsmaster [domena publiczna], źródło: Wikimedia Commons. Jon cyjanku ma samochód samochodowy i jeden z azotu zjednoczonych przez siebie nawzajem.
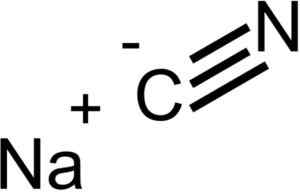 Jony, które tworzą cyjanku sodu nacn. Epop [domena publiczna]. Źródło: Wikimedia Commons.
Jony, które tworzą cyjanku sodu nacn. Epop [domena publiczna]. Źródło: Wikimedia Commons. Nacn ma tę samą strukturę krystaliczną co NaCl, więc jego kryształy są sześcienne.
Nomenklatura
-Cyjanek sodowy
-Cyjanek sodowy
Nieruchomości
Stan fizyczny
Higroskopijne białe krystaliczne stałe (wchłanianie wody ze środowiska).
Waga molekularna
49 007 g/mol
Temperatura topnienia
563,7 ºC
Punkt wrzenia
1496 ° C
Temperatura zapłonu
To nie jest łatwopalne. Ale jeśli jest narażony na pożar, występują cyjanoru HCN i tlenki azotu.
Może ci służyć: sublimacja: koncepcja, proces i przykładyGęstość
1595 g/cm3 w 20 ° C
Rozpuszczalność
Bardzo rozpuszczalny w wodzie: 48 g/100 ml w 10ºC, 82 g/100 ml w 35 ° C. Lekko rozpuszczalny w alkoholu
Stała dysocjacji
Jest hydrolizowany w roztworze wodnym wytwarzającym cyjankow wodoru HCN. Stała tej hydrolizy wynosi kH = 2,5 x 10-5.
Ph
Roztwory wodne NACN są silnie alkaliczne
Właściwości chemiczne
Podczas rozpuszczania się w wodzie oddziela się w swoich jonach NA+ i Cn-. W roztworze wodnym jon cyjanku CN- Weź proton h+ wody h2Lub tworzenie HCN i OH Ion-, Tak więc roztwór staje się alkaliczny.
Cn- + H2O → HCN + OH-
Z tego powodu ich wodne roztwory szybko rozkładają się przez pozostałe przechowywane, tworząc cyjanek wodoru HCN.
Jest żrący w stosunku do aluminium. Jego roztwory łatwo rozpuszcza AU i Srebrny AG w obecności powietrza.
Jest to środek chelatujący, ponieważ anion cyjankowy CN- Może łatwo dołączyć do innych metali, takich jak srebro, złoto, rtęć, cynk, kadm itp.
Przedstawia słaby zapach gorzkich migdałów.
Ryzyko
Należy obsługiwać bardzo ostrożnie. Jest to wysoce trujący związek, hamuje ważne procesy metaboliczne i prowadzi do śmierci zarówno w celu spożycia, wdychania, wchłaniania skóry, jak i kontaktu wzrokowego.
Jeśli nacn jest wdychany, rozpuszcza się w błonie śluzowej dróg oddechowych i przechodzi do krwioobiegu. Jon cyjanku NaCN ma silne powinowactwo do żelaza w stanie utleniania +3, to znaczy wiary kationowej żelaza3+.
Kiedy cyjanku jest wchłaniany, szybko reaguje z wiarą3+ ważnego enzymu mitochondriów komórek (cytochrom oksydazy), zapobiegając przeprowadzaniu pewnych procesów oddychania.
Dlatego oddychanie komórkowe jest hamowane lub hamowanie i jest cytotoksyczną niedotlenieniem. Oznacza to, że komórki i tkanki nie są w stanie użyć tlenu, zwłaszcza komórek mózgu i serca.
W ten sposób występuje trwałe lub śmiertelne uszkodzenie ciała. Może się to zdarzyć zarówno u ludzi, jak i zwierząt.
Jeżeli przeciążenie naczyń krwionośnych i korozja błony śluzowej żołądka spożywa się, oprócz tego, co już wspomniano.
Może ci służyć: Justus von Liebig Nacn cyjanku sodu może powodować śmierć. Autor: Openicons. Źródło: Pixabay.
Nacn cyjanku sodu może powodować śmierć. Autor: Openicons. Źródło: Pixabay. To nie jest paliwo, ale w kontakcie z kwasami, uwalnia HCN, który jest wysoce łatwopalny i toksyczny.
Jeśli topi się azotynami lub chloranami, może wykorzystać.
Uzyskanie
Można go uzyskać za pomocą sodu NA, amoniaku NH3 i węgiel c. Sód reaguje z amoniakiem, dając nanh sodu2:
2 Na + 2 NH3 → 2 Nanh2 + H2↑
Amid sodu ogrzewa się węglem w temperaturze 600 ° C i wytwarza cyjanamid sodu na2NCN, który następnie z węglem w 800 ° C staje się cyjankiem sodu:
2 Nanh2 + C → 2 H2↑ + na2Ncn
Na2NCN + C → 2 NACN
Inną metodą jest stopienie wapnia i węgla cyjanamidu C z węglanem sodu Na2WSPÓŁ3:
Cancn + C + na2WSPÓŁ3 → Caco3 + 2 nacn
Można go również przygotować, przepuszczając gaz azotowy n2 dla gorącej mieszaniny węglanu sodu2WSPÓŁ3 i węgiel C sproszkowany, wykorzystując wiarę wiary jako katalizator lub akcelerator reakcji:
Na2WSPÓŁ3 + 4 c + n2 → 2 NaCN + 3 CO ↑
Aplikacje
W ekstrakcji minerałów złota i srebra. Konsekwencje
Cyjan sodu był używany od dawna do wydobywania złota i srebrnych metali z minerałów.
Cyjanek użyty w tym procesie jest poddany recyklingowi, ale coś ucieka przed stawem odpadowym wraz z metali ciężkich.
Ptaki, nietoperze i inne zwierzęta, które piją z tych laguonów z cyjankiem, zostały zatrute.
Istnieją zapisy tamy rumuńskiej, która utrzymywała izolowany staw odpadowy i został uszkodzony przez zdarzenie pogodowe.
W konsekwencji mnóstwo cyjanku zostało zwolnionych do rzeki Sasar i pobliskich systemów warstw wodonośnych, takich jak Lapus, Somes, Tisza Rivers, kończący się w Dunaju.
Spowodowało to wodospad śmierci zwierząt lub innymi słowy, katastrofa ekologiczna.
 Ekstrakcja złota z cyjankiem w Nowej Zelandii około 1918 roku. Możesz zobaczyć ilość zanieczyszczonej wody, która została zwolniona w pobliskich rzekach. Biblioteka Narodowa NZ na temat Commons [bez ograniczeń]. Źródło: Wikimedia Commons.
Ekstrakcja złota z cyjankiem w Nowej Zelandii około 1918 roku. Możesz zobaczyć ilość zanieczyszczonej wody, która została zwolniona w pobliskich rzekach. Biblioteka Narodowa NZ na temat Commons [bez ograniczeń]. Źródło: Wikimedia Commons. W produkcji innych związków chemicznych
Nacn cyjanku sodu jest stosowany w syntezie różnych rodzajów związków organicznych.
Może ci służyć: tlenek sodu (Na2O): struktura, wzór, właściwości, ryzykoNa przykład przygotowuje się pigmenty i barwniki (w tym lakiery optyczne), związki do stosowania w rolnictwie lub agrochemiku i różnych produktach farmaceutycznych.
Służy również do uzyskania środków chelatowych lub porwających jonów metali.
Za pomocą cyjanku sodu przygotowuje się związki zwane nitliami, które po traktowaniu kwasem kwaśnym lub wodnym roztworem alkalicznym pozwala na uzyskanie kwasów karboksylowych.
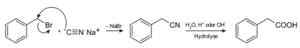 Przygotowanie kwasu karboksylowego za pomocą cyjanku sodu nacn. Roland Mattern [domena publiczna]. Źródło: Wikimedia Commons.
Przygotowanie kwasu karboksylowego za pomocą cyjanku sodu nacn. Roland Mattern [domena publiczna]. Źródło: Wikimedia Commons. Pozwala na przygotowanie kwasów tłuszczowych z grupami cyjanowymi, cyjankami metali ciężkich i hydrogenowego cyjanku HCN.
W branży metali
NACN jest stosowany w roztworach stosowanych w galwanoplastyce lub elektrodzie metalowej (powłoka metalowa z innymi) na przykład cynk.
Jest składnikiem stali stalowej. Służy również w czyszczeniu metali.
W innych zastosowaniach
Cyjanek sodu jest pośrednikiem w produkcji nylonu.
Służy do oddzielenia minerałów przez flotację pianką.
Aplikacje bez użycia, przesłuchane lub bardzo rzadkie
Naród został użyty do wyeliminowania gryzoni, takich jak króliki i szczury i ich nory, a także do końca gniazd termitów.
Obecnie jest używany od czasu do czasu do wyeliminowania kojotów, lisów i dzikich psów. Jest używany w postaci kapsułek jako prostych lub wielu dawek w wypasach, polowaniu i lasach.
Ze względu na jego ekstremalną toksyczność, NACN musi być używany tylko przez przygotowanych ludzi.
To zastosowanie jest uważane za bardzo niebezpieczne dla człowieka, ale są tacy, którzy nadal go używają.
 Dzikiego życia nie należy eliminować, ponieważ zwierzęta te już walczą o przetrwanie w trudnych warunkach. Autor: Maxwdhs. Źródło: Pixabay.
Dzikiego życia nie należy eliminować, ponieważ zwierzęta te już walczą o przetrwanie w trudnych warunkach. Autor: Maxwdhs. Źródło: Pixabay. W rolnictwie był wcześniej używany do fumigacji drzew owocowych cytrusowych i innych owoców. Zastosowano go również jako środki owadobójcze i mitobójcze (eliminator roztoczy) po zbiorze, do nieudanych cytrusów lub do fumigacji ciężarówek używanych do ich transportu. Był również używany do fumigacji statków, wagonów i magazynów.
Wszystkie te zastosowania zostały zakwestionowane przez wysoką toksyczność cyjanku sodu. Z tego powodu nie jest już używany ani tylko bardzo rzadko i w bardzo kontrolowanych warunkach.
Bibliografia
- LUB.S. National Library of Medicine. (2019). Cyjanek sodowy. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Kirk-Othmer (1994). Encyklopedia technologii chemicznej. Czwarta edycja. John Wiley & Sons.
- Hurst, godz.I. i Martin, m.D. (2017). Toksykologia. Cyjanek. W farmakologii i terapeutyce dla stomatologii (wydanie siódme). Odzyskane z naukowym.com.
- Coppock, r.W. i Dziwenka, m. (2015). Zagrożenia dla dzikiej przyrody przez środki chemiczne. W Handbook of Toxicology of Chemical Warfare Agents (wydanie drugie). Odzyskane z naukowym.com.
- Morrison, r.T. i Boyd, r.N. (2002). Chemia organiczna. 6. edycja. Prentice-Hall.
- « Struktura trójtlenku siarki (SO3), właściwości, ryzyko, używa
- Struktura tlenku baru (BAO), właściwości, zastosowania, ryzyko »

