Struktura trójtlenku siarki (SO3), właściwości, ryzyko, używa
- 1164
- 181
- Bertrand Zawadzki
On TRIOTOLENSIDE SUARKI Jest to związek nieorganiczny utworzony przez zjednoczenie atomu (Siarki) i 3 atomów tlenu (O). Jego wzór molekularny jest taka3. W temperaturze pokojowej SO3 Jest to ciecz, która wydziela gazy w powietrzu.
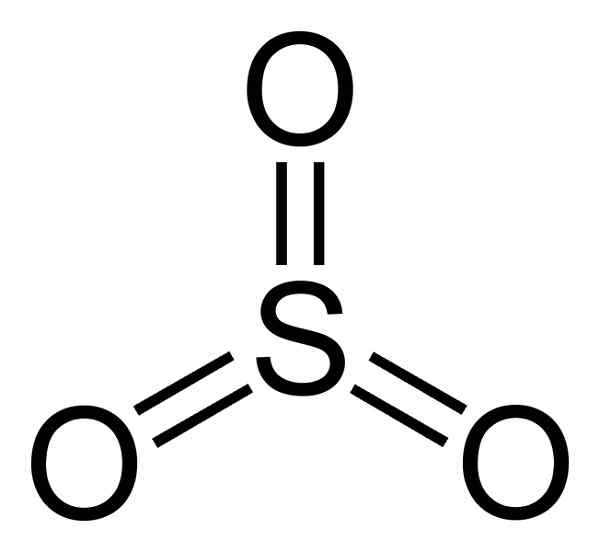
Struktura SO3 Gaza jest płaska i symetryczna. Trzy tlen znajdują się równo wokół siarki. SO3 Reaguje gwałtownie wodą. Reakcja jest egzotermiczna, co oznacza, że ciepło jest wytwarzane, innymi słowy, wiele jest podgrzewane.
 SUKT TRIOROKULA SOBO3. Autor: Benjah-BMM27. Źródło: Wikimedia Commons.
SUKT TRIOROKULA SOBO3. Autor: Benjah-BMM27. Źródło: Wikimedia Commons. Kiedy SO3 Ciekłe chłodzi, staje się stałą, która może mieć trzy rodzaje struktury: alfa, beta i gamma. Najbardziej stabilny jest alfa, w postaci warstw wraz ze sobą, stanowiąc sieć.
Gaza trutlenku siarki służy do przygotowania palenia kwasu siarkowego, zwanego również olejem, ze względu na jego podobieństwo oleju lub tłustej substancji. Kolejnym z jego ważnych zastosowań jest sulfonacja związków organicznych, to znaczy dodawanie grup -3- do tych. Zatem można przygotować przydatne chemikalia, takie jak detergenty, barwniki, pestycydy, między innymi.
SO3 Jest bardzo niebezpieczny, może powodować poważne oparzenia, oczy i uszkodzenie skóry. Nie powinien być też wdychany ani połknięty, ponieważ może powodować śmierć przez oparzenia wewnętrzne, w jamie ustnej, przełyku, żołądku itp.
Z tych powodów należy go manipulować z wielką ostrożnością. Nigdy nie należy kontaktować się z wodą ani materiałami palnymi, takimi jak drewno, papier, tkaniny itp., Cóż, można wyprodukować ogień. Nie powinno być nie odrzucane lub kanalizacji ze względu na niebezpieczeństwo wybuchu.
SO3 Gaza generowana w procesach przemysłowych nie powinna być uwalniana do środowiska, ponieważ jest to jeden z osób odpowiedzialnych za kwaśne deszcz, który już uszkodził duże rozszerzenia lasów na świecie.
[TOC]
Struktura
Tak więc cząsteczka trójtlenku siarki3 W stanie gazowym ma płaską trójkątną strukturę.
Oznacza to, że zarówno siarka, jak i trzy tlen znajdują się w tej samej płaszczyźnie. Ponadto rozkład tlenu i wszystkich elektronów jest symetryczny.
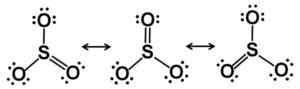 Rezonans Lewis Starcutures. Elektrony są równie rozłożone w SO3. Autor: Marilú Stea.
Rezonans Lewis Starcutures. Elektrony są równie rozłożone w SO3. Autor: Marilú Stea. W stanie stałym znane są trzy typy struktury SO3: Alfa (α-so3), beta (β-so3) i gamma (γ-so3).
Gamma tworzy γ-so3 zawiera cykliczne trymery, to znaczy trzy jednostki3 razem tworząc cykliczną lub pierścieniową cząsteczkę w kształcie pierścienia.
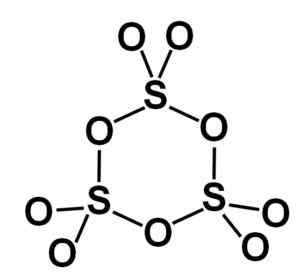 Cząsteczka pierścienia gamma typu trutlenku siarki stały. Autor: Marilú Stea.
Cząsteczka pierścienia gamma typu trutlenku siarki stały. Autor: Marilú Stea. Faza beta β-TO3 Ma nieskończone helikalne łańcuchy kompozycji tetrahedr4 zjednoczeni ze sobą.
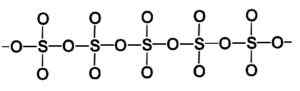 Struktura beta typu trójtlenku siarki stałej. Autor: Marilú Stea.
Struktura beta typu trójtlenku siarki stałej. Autor: Marilú Stea. Najbardziej stabilnym sposobem jest alfa α-TO3, podobne do beta, ale ze strukturą warstwy, z United Chains tworzą sieć.
Nomenklatura
-TRIOTOLENSIDE SUARKI
-Bezwodnik siarkowy
-Tlenek siarkowy
-południowy zachód3 Gamma, γ-SO3
-południowy zachód3 beta, β-so3
-południowy zachód3 Alfa, α-SO3
Właściwości fizyczne
Stan fizyczny
W temperaturze pokojowej (około 25 ° C) i ciśnieniu atmosferycznym SO3 Jest to bezbarwny ciecz, który emituje opary w powietrzu.
Kiedy SO3 Ciecz jest czysta w temperaturze 25 ° C3 monomeryczny (pojedyncza cząsteczka) i trimeryczne (3 powiązane cząsteczki) wzorów s3ALBO9, również to nazywane3 Gamma γ-SO3.
Może ci służyć: Skala Rankine: co to jest, konwersje, przykładyPodczas obniżenia temperatury, jeśli SO3 Jest czysty, gdy osiąga 16,86 °3, nazywany także „So Ice3".
Jeśli zawiera niewielkie ilości wilgotności (nawet wyjątkowo małe ślady lub ilości)3 Polimeryzuje beta β-TO3 który tworzy kryształy o jedwabistej jasności.
Następnie powstaje więcej związków przez wygenerowanie struktury α-TO3, który jest krystaliczną substancją stałą w postaci igieł, które przypominają azbest lub azbest.
Kiedy stopienie alfa i beta generują gamma.
Waga molekularna
80,07 g/mol
Temperatura topnienia
południowy zachód3 Gamma = 16,86 ºC
Potrójny punkt
Jest to temperatura, w której obecne są trzy stany fizyczne: stałe, ciekłe i gazowe. W formie alfa potrójna punkt wynosi 62,2 ° C, aw wersji beta wynosi 32,5 ° C.
Przez ogrzewanie formy alfa ma większą tendencję do sublimizacji niż do stopienia. Sublimimar oznacza przejście od stanu stałego do napoju gazowanego, bez przechodzenia przez stan płynny.
Punkt wrzenia
Wszystkie formy tak3 gotować w 44,8 ° C.
Gęstość
SO3 Ciecz (gamma) ma gęstość 1 9225 g/cm3 w 20 ° C.
SO3 Gasea ma gęstość 2,76 w stosunku do powietrza (powietrze = 1), co wskazuje, że jest cięższy niż powietrze.
Ciśnienie pary
południowy zachód3 Alfa = 73 mm Hg w 25 ° C
południowy zachód3 beta = 344 mm Hg w temperaturze 25 ° C
południowy zachód3 Gamma = 433 mm Hg w 25 ° C
Oznacza to, że forma gamma ma tendencję do łatwiejszego odparowania niż beta i że alfa.
Stabilność
Forma alfa jest najbardziej stabilną strukturą, pozostałe są metastabilne, to znaczy są mniej stabilne.
Właściwości chemiczne
SO3 reaguje energetycznie z wodą, aby dać kwas siarkowy H2południowy zachód4. Podczas reakcji jest bardzo ciepło, aby pary wodne szybko odłączają się od mieszanki.
Bycie narażonym na powietrze SO3 Szybko pochłonąć wilgoć, emitując gęste opary.
Jest to bardzo silny środek odwadniający, oznacza to, że łatwo eliminuje wodę z innych materiałów.
Siarka SO3 Ma powinowactwo do wolnych elektronów (to znaczy elektronów, które nie są w związku między dwoma atomami), więc ma tendencję do tworzenia kompleksów ze związkami, które je posiadają, takie jak pirydyna, trimetyloamina lub dioksan.
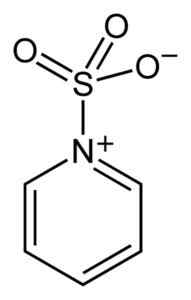 Kompleks między trójtlenkiem siarki i pirydyny. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons.
Kompleks między trójtlenkiem siarki i pirydyny. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons. Tworząc kompleksy, siarka przyjmuje „pożyczyło” elektrony drugiego związku, aby zaspokoić ich brak. TRIOTLENEKID SULFURY jest nadal dostępny w tych kompleksach, które są stosowane w reakcjach chemicznych w celu zapewnienia3.
Jest to potężny odczynnik sulfonantów związków organicznych, co oznacza, że służy on do łatwego dodawania grupy -3- Do cząsteczek.
Łatwo reaguje z tlenkami wielu metali, aby dać siarczany tych metali.
Jest żrący w stosunku do metali, tkanek zwierzęcych i roślinnych.
SO3 Jest to trudny materiał do obsługi z kilku powodów: (1) jego temperatura wrzenia jest stosunkowo niska, (2) ma tendencję do tworzenia stałych polimerów w temperaturach mniejszych niż 30 ° C i (3) ma wysoką reaktywność na prawie wszystkie substancje organiczne I woda.
Może ci służyć: amorficzne stałe: struktura, właściwości, przykładyMoże wybuchowo polimeryzować, jeśli nie zawiera stabilizatora i jest obecność wilgoci. Jako stabilizatory stosuje się dimetylosarczan lub tlenek boru.
Uzyskanie
Jest uzyskiwany przez reakcję w 400 ° C między dwutlenkiem siarki2 i tlen molekularny lub2. Jednak reakcja jest bardzo powolna i wymagane są katalizatory w celu zwiększenia prędkości tego.
2 Tak2 + ALBO2 ⇔ 2 SO3
Wśród związków, które przyspieszają tę reakcję, są Platino Metal PT, pentlenek wanadu V2ALBO5, Tlenek żelazowy2ALBO3 i tlenek azotu.
Aplikacje
W przygotowaniu oleju
Jedno z jego głównych zastosowań polega na przygotowaniu oleju lub dymu kwasu siarkowego, zwanego, ponieważ emituje widoczne opary do nagiego oka. Aby to uzyskać, SO jest wchłaniane3 W skoncentrowanym kwasie siarkowym H2południowy zachód4.
 Pu -sulfuric oleum lub palenie. Możesz zobaczyć biały dym wychodzący z butelki. W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons.
Pu -sulfuric oleum lub palenie. Możesz zobaczyć biały dym wychodzący z butelki. W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons. Odbywa się to w specjalnych wieżach ze stali nierdzewnej, gdzie stężony kwas siarkowy (który jest ciekł)3 Gaseous idzie.
Ciecz i gaz wchodzą w kontakt i dołączają, tworząc oleum, które jest tłustą cieczą. To ma mieszankę H2południowy zachód4 A więc3, ale ma również cząsteczki kwasu disiulfurowego h2S2ALBO7 i Trisulfuric H2S3ALBO10.
W reakcjach chemicznych sulfonacji
Sulfonowanie jest kluczowym procesem w dużą skalę przemysłowych zastosowań do produkcji detergentów, środków powierzchniowo czynnych, barwników, pestycydów i produktów farmaceutycznych.
SO3 Służy jako środek sulfonowy do przygotowywania olejków sulfonowych i detergentów alkilowo-sulfonowych, wśród wielu innych związków. Poniżej znajduje się reakcja sulfonacji związku aromatycznego:
ARH + SO3 → Arso3H
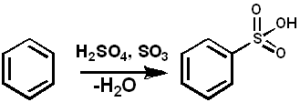 Sulfonacja benzenu3. PEDRO8410 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons.
Sulfonacja benzenu3. PEDRO8410 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons. W przypadku reakcji sulfonacji można użyć oleum3 w postaci swoich kompleksów z pirydyną lub trimetyloaminą, między innymi.
W ekstrakcji metalu
Gas s3 Został zastosowany w leczeniu minerałów. Proste tlenki metali mogą stać się znacznie bardziej rozpuszczalne siarczany podczas leczenia ich3 w stosunkowo niskich temperaturach.
Minerały siarki, takie jak piryt (siarczk żelaza), przewód3 Pozwala na te metale łatwo i przy niskich kosztach.
Żelazo, nikiel i siarki miedzi reagują z SO GAS3 nawet w temperaturze pokojowej, tworząc odpowiednie siarczany, które są bardzo rozpuszczalne i mogą być poddawane innym procesom w celu uzyskania czystego metalu.
W kilku zastosowaniach
SO3 Służy do przygotowania kwasu chlorosulfurowego zwanego także kwasem chlorosulfonowym HSO3Cl.
TRIOTOLENEK SULFURY jest bardzo potężnym utleniaczem i jest stosowany w produkcji wybuchowej.
Ryzyko
Do zdrowia
SO3 Jest to wysoce toksyczny związek na wszystkich drogach, to znaczy inhalacja, spożycie i kontakt skóry.
Iryrita i korodowia błony śluzowe. Powoduje skórę i oczy. Jego opary są bardzo toksyczne, gdy są wdychane. Wewnętrzne oparzenia są wytwarzane, trudność oddychania, ból w klatce piersiowej i obrzęk płuc.
Może ci służyć: Butanone: Struktura, właściwości i zastosowania TRIOTLENCEK SULFUR SO3 jest bardzo żrący i niebezpieczny. Autor: Openicons. Źródło: Pixabay.
TRIOTLENCEK SULFUR SO3 jest bardzo żrący i niebezpieczny. Autor: Openicons. Źródło: Pixabay. To jest trujące. Jego spożycie generuje ciężkie oparzenie, przełyk i żołądek. Ponadto podejrzewa się, że jest to rakotwórczy.
Ogień lub eksplozja
Reprezentuje niebezpieczeństwo ognia, gdy kontaktuje się z materiałami organicznymi, takimi jak drewno, włókna, papier, olej, bawełna, szczególnie jeśli są mokre.
Istnieje również ryzyko, jeśli masz kontakt z bazami lub zmniejszając czynniki. Jest to wybuchowo z wodą, tworząc kwas siarkowy.
Kontakt z metali może wytwarzać gaz hydrogenowy H2 który jest bardzo łatwopalny.
Należy unikać na naczyniach szklanych, aby zapobiec możliwym gwałtownym pęknięciu pojemnika.
Wpływ środowiska
SO3 Jest uważany za jeden z największych zanieczyszczeń obecnych w atmosferze Ziemi. Wynika to z jego roli w tworzeniu aerozoli i jego wkładu w kwaśny deszcz (ze względu na tworzenie kwasu siarkowego H2południowy zachód4).
 Las uszkodzony przez kwasowy deszcz w Czechach. Lovecz [domena publiczna]. Źródło: Wikimedia Commons.
Las uszkodzony przez kwasowy deszcz w Czechach. Lovecz [domena publiczna]. Źródło: Wikimedia Commons. SO3 Powstaje w atmosferze z powodu utleniania dwutlenku siarki2. Kiedy SO jest utworzone3 To szybko reaguje z wodą, tworząc kwas siarkowy H2południowy zachód4. Według ostatnich badań istnieją inne mechanizmy transformacji SOS3 W atmosferze, ale ze względu na dużą ilość wody obecnej w tym3 Przekształcone głównie na H2południowy zachód4.
SO3 Gazowe lub przemysłowe odpady gazowe, które zawierają go nie należy pobierać do atmosfery, ponieważ jest to niebezpieczne zanieczyszczenie. Jest to wyjątkowo reaktywny gaz i, jak już powiedziano powyżej, w obecności wilgoci powietrza SO3 Staje się kwasem siarkowym h2południowy zachód4. Dlatego w powietrzu SO3 utrzymuje się w postaci kwasu siarkowego tworzącego małe kropelki lub aerozol.
Jeśli kropelki kwasu siarkowego dostają się do układów oddechowych człowieka lub zwierząt, szybko rosną z powodu obecnej wilgoci, więc mają możliwość penetracji płuc. Jeden z mechanizmów kwasu2południowy zachód4 (To tak3) Może wytwarzać silną toksyczność, ponieważ zmienia się zewnątrzkomórkowe i wewnątrzkomórkowe pH żywych organizmów (rośliny, zwierzęta i istota ludzka)).
Według niektórych naukowców, więc mgła3 Jest to przyczyna wzrostu astmatyki w obszarze Japonii. Mgła tak3 Ma bardzo żrący wpływ na metale, więc metalowe konstrukcje zbudowane przez człowieka, takie jak niektóre mosty i konstrukcje.
SO3 cieczy nie należy odrzucić w drenażu brudnych wód lub kanalizacji. Jeśli zostanie wlany do kanalizacji, możesz stworzyć niebezpieczeństwo ognia lub wybuchu. Jeśli zostanie rozlany przez przypadek, strumień wody nie powinien być skierowany na produkt. Nigdy nie powinien być wchłaniany trociny lub innym paliwem chłonnym, ponieważ może generować pożary.
Powinien być wchłaniany w suchym piasku, suchym lądzie lub innym całkowicie suchym obciążeniu. SO3 Nie należy go wlać do środowiska i nigdy nie powinien się z tym skontaktować. Należy go trzymać daleko od źródeł wody, ponieważ dzięki temu wytwarza kwas siarkowy, który jest szkodliwy dla organizmów wodnych i lądowych.
Bibliografia
- Sarkar, s. i in. (2019). Wpływ amoniaku i wody na los trójtlenku siarki w troposferze: teoretyczne badania szlaków tworzenia kwasu sulfamowego i. J Phys Chem a.2019; 123 (14): 3131-3141. NCBI odzyskało.NLM.Nih.Gov.
- Muller, t.L. (2006). Kwas siarkowy i trójtlenek siarkowy. Kirk-Othmer Encyclopedia of Chemical Technology. Tom 23. Pobrano z biblioteki online.Wiley.com.
- LUB.S. National Library of Medicine. (2019). Siarka trójtlenku. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Kikuchi, r. (2001). Zarządzanie środowiskiem w zakresie trójtlenku siarki: Wpływ tego3 O zdrowiu ludzi. Environmental Management (2001) 27: 837. Link odzyskał.Skoczek.com.
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Ismail, m.Siema. (1979). Ekstrakcja metali z siarków za pomocą trójtlenku siarki w złożu płynnym. J. Chem. Tech. Biotechnol. 1979, 29, 361-366. Pobrano z biblioteki online.Wiley.com.
- « Malawi Lago Geografia, geologia, znaczenie, fauna, rios
- Struktura cyjanku sodu (NACN), właściwości, ryzyko, używa »

