Charakterystyka Valina, funkcje, bogata żywność, korzyści
- 1725
- 413
- Marianna Czarnecki
Valina Należy do 22 aminokwasów zidentyfikowanych jako „podstawowe” składniki białek; Jest to identyfikowane z akronimem „Val” i z literą „V”. Ten aminokwas nie może być syntetyzowany przez ludzkie ciało, dlatego jest ono katalogowane w grupie dziewięciu niezbędnych aminokwasów dla ludzi.
Wiele białek kulistych ma wnętrze bogate w odpady waliny i leucyny, ponieważ oba są związane przez interakcje hydrofobowe i są niezbędne do składania struktury i trójwymiarowej konformacji białek.
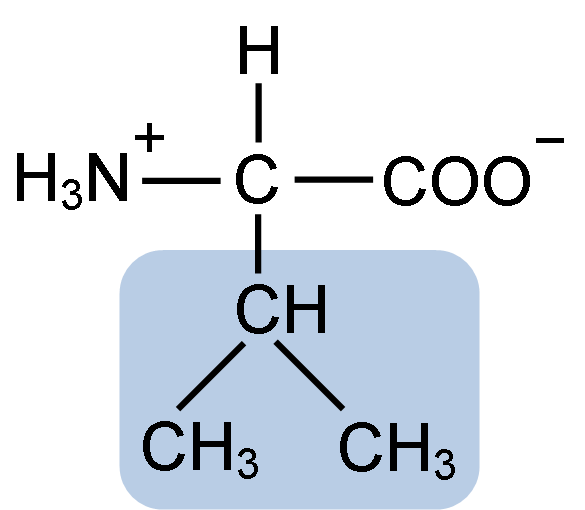
 Struktura chemiczna aminokwasowego waliny (źródło: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons)
Struktura chemiczna aminokwasowego waliny (źródło: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons) La Valina została oczyszczona po raz pierwszy w 1856 roku przez V. Grup-Besanez z wodnego ekstraktu trzustki. Jednak nazwa „Valina” została wymyślona przez E. Fisher w 1906 roku, kiedy udało mu się zsyntetyzować go sztucznie i zauważył, że jego struktura była bardzo podobna do kwasu Valorory'ego, występującego w roślinach powszechnie znanych jako „Valerianas”.
Walina jest jednym z aminokwasów znalezionych w pozycjach zachowanych w niektórych białkach dzielonych przez kręgowce, na przykład w 80 pozycji cytochromu C kręgowców, leucyna, walina, izoleucyna i metoda w tej samej kolejności w tej samej kolejności w tej samej kolejności.
W tkankach lub biomateriałach o odpornych, twardych i elastycznych cechach, takich jak więzadła, ścięgna, naczynia krwionośne, nici lub sieć, istnieją duże ilości waliny, co zapewnia elastyczność i oporność dzięki jej hydrofobowym interakcjom z innymi aminokwasami.
Zastąpienie pozostałości glutaminianowej jedna z waliny w łańcuchu β hemoglobiny, białka odpowiedzialnego za transport tlenu przez krew powoduje złe tworzenie się w strukturze białka, co powoduje hemoglobinę „S”.
Ta mutacja wytwarza niedokrwistość lub drepanocytozę, stan patologiczny, w którym czerwone krwinki nabierają formy półksiężyca lub charakterystycznego Hoz, który odróżnia je od normalnego, zaokrąglonego i spłaszczonego wyglądu.
Niektóre z najczęściej używanych herbicydów mają obecnie aktywne związki do sulfonylomocznika i metylosulfometeturonu, które powodują uszkodzenie syntazy acetolaktów enzymu, niezbędne do pierwszego etapu syntezy waliny, leucyny i izoleucyny. Uszkodzenia spowodowane przez te pestycydy zapobiegają ziołom i chwastom mogą normalnie rozwinąć się.
[TOC]
Charakterystyka
Valina jest aminokwasem z pięciokadowym szkieletem i należy do grupy aminokwasowej z alifatycznymi łańcuchami bocznymi. Jego hydrofobowy charakter jest taki, że można go porównać z fenyloalaniną, leucyną i izoleucyną.
Aminokwasy, które mają łańcuchy węglowodorowe w swoich łańcuchach r r lub bocznych, są powszechnie znane w bibliografii jako rozgałęzione lub rozgałęzione aminokwasy łańcuchowe. W tej grupie są walina, fenyloalanina, leucyna i izoleucyna.
Zasadniczo aminokwasy tej grupy są stosowane jako wewnętrzne elementy strukturalne w syntezie białek, ponieważ można je powiązać poprzez interakcje hydrofobowe, „uciekające” z wody i ustanawianie charakterystycznego strukturalnego fałdowania wielu białek.
Jego masa cząsteczkowa wynosi około 117 g/mol, a ponieważ jego grupa łańcucha R lub bocznego jest rozgałęzionym węglowodorem, nie ma obciążenia, a jego względna obfitość w strukturach białkowych jest nieco większa niż 6%.
Struktura
La Valina dzieli ogólną strukturę i trzy typowe grupy chemiczne wszystkich aminokwasów: grupa karboksylowa (COOH), grupa aminowa (NH2) i atom wodoru (-H). W grupie R lub Ber Cain ma trzy atomy węgla, które nadają mu bardzo hydrofobowe cechy.
Może ci służyć: istoty bezwładne: cechy, przykłady, różnice w żywych istotachJak jest to prawda w przypadku wszystkich związków chemicznych sklasyfikowanych jako „aminokwasy”, walina ma centralny atom węgla, który jest chiralny i znany jako węgiel α, do którego wymienione cztery grupy chemiczne wymienione.
IUPAC Nazwa Valine to 2-3-amino-3-butanóic.
Wszystkie aminokwasy można znaleźć w postaci D lub L, a walina nie jest wyjątkiem. Jednak forma wartości L jest znacznie bardziej obfita niż postać d-valleine, a ponadto jest spektroskopowo bardziej aktywna niż forma D.
Wartość L jest formą stosowaną do tworzenia białek komórkowych i dlatego jest z dwóch, biologicznie aktywnej. Wypełnia funkcje, takie jak nutraceutyczne, mikroelementy dla roślin, metabolit dla ludzi, glonów, drożdży i bakterii, wśród wielu innych funkcji.
Funkcje
Valina, mimo że jest jednym z dziewięciu niezbędnych aminokwasów, nie odgrywa dodatkowej roli w jej uczestnictwie w syntezie białek i jako metabolit we własnej trasie degradacji.
Jednak nieporęczne aminokwasy, takie jak walina i tyrozyna, są odpowiedzialne za elastyczność fibroiny, główny składnik białkowy jedwabnych nici wytwarzanych przez gatunki gatunku Bombyx Mori, powszechnie znane jako jedwabne lub morskie robaki drzew.
Tkanki, takie jak więzadła krwi tętnicze i szklanki, składają się z włóknistego białka znanego jako elastyna. Składa się z łańcuchów polipeptydowych z powtarzającymi się sekwencjami glicyny, alaniny i aminokwasów valinowych, najważniejszych pozostałości z białkiem.
Valina uczestniczy w głównych drogach syntezy związków odpowiedzialnych za charakterystyczny zapach owoców. Cząsteczki Valina są przekształcane w metylowane i rozgałęzione pochodne estrów i alkoholi.
W branży spożywczej
Istnieje wiele dodatków chemicznych, które wykorzystują valinę w połączeniu z glukozą w celu uzyskania apetycznych zapachów w niektórych preparatach kulinarnych.
W temperaturze 100 ° C dodatki te mają charakterystyczny zapach żyta i w gorącej czekoladzie ponad 170 ° C, więc są popularne w produkcji żywności w branży piekarza i ciasta (ciasto).
Te dodatki chemiczne wykorzystują sztucznie zsyntetyzowaną L-Valin.
Biosynteza
Wszystkie rozgałęzione aminokwasy łańcuchowe, takie jak walina, leucyna i izoleucyna, są głównie syntetyzowane w roślinach i bakteriach. Co oznacza, że zwierzęta takie jak istota ludzka i inne ssaki muszą spożywać pokarmy bogate w te aminokwasy, aby móc spełnić ich wymagania żywieniowe.
Zwykle biosynteza waliny rozpoczyna się od przeniesienia dwóch atomów węgla z pirofosforanu hydroksyetylo -tyaminowego do pirogronianu przez działanie enzymu oketohydroksy -kwas kwasowo -kwasowy reduktaza kwasu kwasu.
Dwa atomy węgla pochodzą z drugiej cząsteczki pirogronianu poprzez reakcję zależną od TPP bardzo podobną do tej katalizowanej przez enzym pirogronian dyskarboksylazy, ale który jest katalizowany przez dehydratazę kwasu dihydroksy-kwas.
Enzyma aminotransferaza, wreszcie, zawiera grupę aminową do związku ketoacidowego wynikającego z przedniej dekarboksylacji, która tworzy L-walinę. Aminokwasy leucyny, izoleucyny i waliny mają duże podobieństwo strukturalne, a to dlatego, że wiele pośredników i enzymów dzieli się na swoich trasach biosyntetycznych.
Może ci służyć: flora i fauna de salta: bardziej reprezentatywne gatunkiKetoacid wytwarzany podczas biosyntezy L-Valine reguluje niektóre etapy enzymatyczne poprzez ujemne sprzężenie zwrotne lub regulację alosteryczną na biosyntetycznej drodze leucyny i innych powiązanych aminokwasów.
Oznacza to, że trasy biosyntetyczne są hamowane przez metabolit generowany w nich, który po nagromadzeniu daje komórkom specyficzny sygnał, który mówi im, że pewien aminokwas jest nadmiernie, a zatem jego synteza może się zatrzymać.
Degradacja
Pierwsze trzy etapy degradacji Valine są wspólne na trasie degradacji wszystkich rozgałęzionych aminokwasów.
Valina może wejść do cyklu kwasu cytrynowego Krebsa, aby przekształcić się w sukcynylo-CoA. Trasa degradacji składa się z początkowego transaminacji, katalizowanej przez enzym znany jako aminotransferaza rozgałęzionych aminokwasów (BCAT).
Ten enzym katalizuje odwracalne transaminację, które udaje się przekształcić rozgałęzione aminokwasy łańcucha w odpowiadające im rozgałęzione łańcuchowe α-Zo-styl.
W tej reakcji niezbędny jest udział glutaminianu/2-zotoglutaranu, ponieważ 2-Zotoglutaran otrzymuje grupę aminową, która jest usuwana z metabolizowanego aminokwasu i staje się glutaminianem.
Ten pierwszy etap reakcji katabolizmu waliny wytwarza 2-cetoisawallerator i towarzyszy mu konwersja pirydoksalnego 5'-fosforanu (PLP) w 5'-fosforanu pirydoksaminy (PMP).
Następnie 2-cetoiswalażer jest stosowany jako substrat mitochondrialnego kompleksu enzymatycznego, znanego jako α-α-Z-ZO-SOATS o rozgałęzionym łańcuchu, który dodaje część Coasha i tworzy izobutiril-CoA, który następnie jest odwodniany i zamieniony w metacylililski -Coa.
Metakrylil-CoA jest przetwarzany w dół rzeki w 5 dodatkowych etapach enzymatycznych, które obejmują nawodnienie, eliminację części COASH, utlenianie, dodanie innej części Coasha i reorganizację molekularną, które kończą się na wytwarzaniu sucynylo-CoA, które natychmiast wchodzi w cykl KREBS.
Pokarmy bogate w Walinę
Białka zawarte w nasionach sezamu lub sezamu są bogate w Walinę, z prawie 60 mg aminokwasu dla każdego grama białka. Z tego powodu zalecane są pliki cookie, ciastka i bary sezamowe lub nougat.
Ziarna sojowe ogólnie są bogate we wszystkie niezbędne aminokwasy, nawet w Walinie. Są jednak biedni w metioninie i cysteinie. Teksturowane białko lub sojowe ma bardzo złożone struktury czwartorzędowe, ale które są łatwe do rozpuszczenia i oddzielenia na mniejsze podjednostki w obecności soków żołądka.
Kazeina, która zwykle znajduje się w mleku i jej pochodnych, jest bogata w powtarzane sekwencje Waliny. Podobnie jak soja, to białko jest łatwo degradowane i wchłaniane w przewodzie pokarmowym ssaków.
Szacuje się, że na każde 100 gramów białka sojowego połknięto około 4,9 gramów waliny; Podczas gdy na każde 100 ml mleka, około 4,6 ml Waliny jest połknięte.
Inne pokarmy bogate w wspomniane aminokwas to wołowina, ryby i różne rodzaje warzyw i warzyw.
Korzyści z Twojego spożycia
Valine, podobnie jak duża część aminokwasów, jest glikogennym aminokwasem, to znaczy można ją włączyć do trasy glukoneogennej, a wielu neurologów potwierdza, że ich spożycie pomaga utrzymać zdrowie psychiczne, koordynację mięśni i zmniejsza stres.
Może ci służyć: 5 gałęzi głównej biotechnologiiWielu sportowców spożywa skompresowane sprężone w Walinie, ponieważ pomagają w regeneracji tkanek, zwłaszcza tkanek mięśniowych. Bycie aminokwasem zdolnym do połączenia glukoneogenezy pomaga produkcji energii, co jest nie tylko ważne dla aktywności fizycznej, ale także dla funkcjonowania nerwowego.
Walina Foods pomaga utrzymać równowagę związków azotowych w organizmie. Równowaga ta jest niezbędna do generowania energii z połkniętych białek, pod względem wzrostu i gojenia ciała.
Jego zużycie zapobiega uszkodzeniu wątroby i pęcherzyka żółciowego, a także przyczynia się do optymalizacji wielu funkcji ciała.
Jednym z najpopularniejszych suplementów diety między sportowcami w celu zwiększenia objętości mięśni i odzyskiwania mięśni jest BCAA.
Tego rodzaju tabletki składają się z tabletek z mieszaninami różnych aminokwasów, w tym ogólnie obejmujące aminokwasy, takie jak L-Valin, L-izoleucyna i L-leucina; Są również bogate w witaminę B12 i inne witaminy.
Niektóre eksperymenty z świńami wykazały, że wymagania waliny są znacznie wyższe i bardziej ograniczające dla matek podczas etapu karmienia piersią, ponieważ aminokwas pomaga wydzielić mleko i powoduje poprawę tempa wzrostu noworodków niemowląt.
Zaburzenia niedoboru
Dzienne spożycie valiny zalecane dla niemowląt wynosi około 35 mg dla każdego zużytego grama białka, podczas gdy dla dorosłych ilość jest nieco niższa (około 13 mg).
Najczęstsza choroba związana z waliną i innymi rozgałęzionymi aminokwasami łańcuchowymi jest znana jako „choroba moczu z syropem ARCE” lub „Ketoaciduria”.
Jest to stan dziedziczny spowodowany defektem genów, które kodują enzymy dehydrogenowe α-Zo-kwasów pochodzących z leucyny, izoleucyny i waliny, które są niezbędne do ich metabolizowania.
W tej chorobie organizm nie może asymilować któregokolwiek z tych trzech aminokwasów, gdy są one uzyskane z diety, zatem ketoacidów wyprowadzonych i są wydalane w moczu (można je również wykryć w surowicy krwi i w płynie mózgowo -rdzeniowym).
Z drugiej strony, zła dieta w Walinie jest związana z patologii neurologicznych, takich jak padaczka. Może również powodować utratę masy ciała, chorobę Huntingtona, a nawet może skończyć się w rozwoju niektórych rodzajów raka, ponieważ układ naprawy tkanek i synteza biomolekułów są zagrożone.
Bibliografia
- Abu-Baker, s. (2015). Przegląd biochemii: pojęcia i połączenia
- Nelson, zm. L., Lehninger, a. L., & Cox, m. M. (2008). Zasady biochemii lehninger. Macmillan.
- Plimmer, r. H. DO., & Phillips, H. (1924). Analiza białek. Iii. Oszacowanie histydyny i tyrozyny przez bominię. Biochemical Journal, 18 (2), 312
- Plimmer, r. H. DO. (1912). Konstytucja chemiczna białek (vol. 1). Longmans, zielony.
- Torii, k. DO. Z. LUB. ALBO., I iitaka i. (1970). Struktura krystaliczna L-wveniny. Crystallographica Sekcja B: Krystalografia strukturalna i chemia kryształów, 26 (9), 1317-1326.
- Tosti, v., Bertozzi, ur., & Fontana, L. (2017). Korzyści zdrowotne z diety śródziemnomorskiej: mechanizmy metaboliczne i molekularne. The Journals of Gerontology: Series A, 73 (3), 318-326.

