Barwienie Giemsa
- 4472
- 785
- Gabriela Łuczak
 Barwienie Giemsy jest powszechną metodą badania różnych tkanek i próbek krwi
Barwienie Giemsy jest powszechną metodą badania różnych tkanek i próbek krwi Co to jest barwienie Giemsy?
Barwienie Giemsa Jest to rodzaj próbek klinicznych (tkanki, krew), w oparciu o mieszaninę kwasu i podstawowych barwników. Stworzył Gustav Giemsa, niemiecki chemik i bakteriolog, którzy udoskonalili pracę Romanowsky'ego, dodając glicerol w celu stabilizacji związków.
Zmiany wygenerowane w oryginalnej technice Romanowsky'ego pozwoliły znacząco poprawić obserwacje mikroskopowe, dlatego technika została ochrzczona o nazwie barwienia Giemsa.
Będąc prostą techniką do wykonywania, doskonałej funkcjonalności i ekonomicznej, jest obecnie szeroko stosowana w laboratorium klinicznym do zapachu hematologicznego, próbek szpiku kostnego i skaleczeń tkanek.
Technika barwienia Giemsa jest bardzo przydatna do badań cytologicznych, ponieważ pozwala na obserwację określonych struktur komórkowych. Ta technika plasuje cytoplazmy, jądra, jądra, wakuole i granulki komórkowe, nawet odróżniając ślady drobnych chromatyny.
Ponadto można wykryć znaczące zmiany wielkości, kształtu lub zabarwienia jądra, gdzie jest to możliwe.
Fundacja barwienia Giemsa
Barwniki typu Romanowsky'ego mają jako podstawowy kontrast między barwnikami kwasowymi i podstawowymi, aby zabić odpowiednio podstawowe i kwaśne struktury. Jak widać, istnieje powinowactwo kwaśnych barwników farbowania podstawowych struktur i odwrotnie.
Zastosowanym podstawowym barwnikiem jest błękit metylenowy i jego zardzewiałe pochodne (Azure A i Azure B), podczas gdy barwnik kwaśny to eozyna.
Kwaśne struktury komórek to kwasy nukleinowe, granulki bazofilne, między innymi. Dlatego zostaną barwione błękitem metylenowym.
W tym samym sensie podstawowymi strukturami komórek są hemoglobina i niektóre granulki, takie jak zawartość w segmentowanych eozynofilach, między innymi. Zostaną farbowane Eosiną.
Z drugiej strony, ponieważ metylen i błękit lazurowy charakteryzują się jako barwniki metakromatyczne, mogą one dostarczyć zmiennego tonu różnym strukturom.
W ten sposób strategiczne połączenie podstawowych i kwaśnych barwników udaje się opracować szerokie spektrum kolorów, zgodnie z cechami biochemicznymi każdej struktury, przechodząc przez jasnoniebieskie, ciemnoniebieskie, liliowe i fioletowe niebieskie odcienie, w przypadku struktur kwasu kwaśnego.
Kolorowanie dostarczone przez Eosinę jest bardziej stabilne, generując kolory między czerwonawymi, pomarańczowymi i łososiem.
Materiały
Przygotowanie roztworu macierzystego
Przygotowanie roztworu macierzystego wymaga ważenia 600 mg pyłu Giemsa, mierzącym 500 cm3 alkoholu metololicznego bez acetonu i 50 cm3 neutralnej gliceryny.
Tryb przygotowania
Umieść ciężki kurz Gieessa na moździerzu. Jeśli są grudki, należy je sproszkować. Następnie dodaj znaczną ilość zmierzonej gliceryny i bardzo dobrze wymieszaj. Otrzymana mieszanka jest wlewana do bardzo czystej bursztynowej butelki.
Reszta gliceryny jest umieszczana w moździerzu. Wymieszaj ponownie, aby wyczyścić resztę barwnika, który utknął na ścianach zaprawy i rzuć tę samą butelkę.
Może ci służyć: konidiaButelka jest pokryta i zajmuje 2 godziny w kąpieli wodnej w 55 ° C. Jak długo.
Następnie mieszanina może ostygnąć, aby umieścić alkohol. Wcześniej część zmierzonego alkoholu jest umieszczana w moździerzu, aby zakończyć mycie tego, co jest zabarwieniem, a następnie dodaje się do mieszanki, obok reszty alkoholu.
To przygotowanie powinno być dozwolone do dojrzewania przez co najmniej 2 tygodnie. Część używana z roztworu macierzystego musi być filtrowana.
Aby uniknąć zanieczyszczenia przygotowania, zaleca się przekazanie porcji, która będzie stale używana do małej bursztyn. Reracharge za każdym razem, gdy odczynnik jest wyczerpany.
Przygotowanie roztworu buforowego
Z drugiej strony przygotowano roztwór bufora 7,2 pH w następujący sposób:
6,77 GR fosforanu sodu (bezwodne) (nahpo jest ważone4), 2,59 GR fosforanu dihydrogenu potasu (KH2PO4) i wodę destylowaną do 1.000 cm3.
Ostateczne przygotowanie do kolorowania
Do przygotowania końcowego roztworu barwienia mierzono 2 cm3 roztworu matki i mieszane z 6 cm3 roztworu buforowego. Mieszaninę miesza się.
Istotnym faktem, który należy wziąć pod uwagę, jest to, że techniki przygotowania barwnika mogą się zmieniać według domu komercyjnego.
Dodatkowe materiały potrzebne do wykonania zabarwienia
Oprócz opisanych materiałów, mostów zabarwienia, bieżni z wodą lub buforem do mycia, przesuwania plasterków lub osłony, stoper, stoper do kontrolowania czasów zabarwienia i papieru do suszenia lub materiału, który serwuje się do wyschnięcia (guza lub bawełna lub bawełna).
Technika
Proces barwienia
1. Przed kolorowaniem przedłużona próbka na czystym slajdzie powinna być gotowa.
Próbki mogą to być krew, szpik kostny, tkanki histologiczne lub próbki szyjki macicy. Zaleca się, aby przedłużone były w porządku i miały 1 lub 2 godziny suszenia przed ich zabarwieniem.
2. Na mostku kolorowym są umieszczane wszystkie arkusze do pokolorowania. Zawsze działa w tej samej kolejności, a każdy arkusz jest dobrze zidentyfikowany.
3. Umieść kilka kropli alkoholu metalowego 100% (metanolu) na zapachu i pozostaw na 3 do 5 minut, aby naprawić i odwodnić próbkę.
4. Odrzuć metanol obecny w arkuszu i wyschnij w powietrzu.
5. Po wyschnięciu umieść końcowe roztwór barwienia z zakropkiem, aż pokryje cały arkusz. Pozostaw ACT na 15 minut. Niektórzy autorzy zalecają do 25 minut. To zależy od domu komercyjnego.
6. Opróżnij barwnik i umyj wcieranie wodą destylowaną lub roztworem 7,2 bufora.
7. Na papierze suszącym pozwól arkuszom zewnętrznym wyschnąć, ułożone w pionie za pomocą wsparcia.
Może ci służyć: Renina: Struktura, produkcja, wydzielanie, funkcje8. Wyczyść tył zjeżdżalni gazą lub bawełną zwilżoną w alkoholu, aby wyeliminować resztę barwnika.
Używa/zastosowania barwienia Giemsa
Technika barwienia Giemsa jest stosowana w różnych obszarach: w hematologii, mikologii, bakteriologii, parazytologii, cytologii i cytogenetyce.
Hematologia
Jest to najczęstsze zastosowanie tego barwienia. Za pomocą niego zidentyfikowane jest każde komórki obecne w próbkach szpiku kostnego lub krwi obwodowej. Oprócz obliczania liczby każdej serii, w stanie wykryć leukocytozę lub leukopenię, trombocytopenia itp.
Ponieważ jest wrażliwe na identyfikację niedojrzałych komórek, ma to znaczenie w diagnozie ostrej lub przewlekłej białaczki. Możliwe jest również diagnoza niedokrwistości, takiej jak między innymi drepanocytarne, falciformowe.
Mikologia
W tym obszarze jego użycie jest powszechne do poszukiwania Histoplasma capsulatum (wewnątrzkomórkowy grzyb dimorficzny) w próbkach tkanek.
Bakteriologia
W rozmazie hematologicznym barwionym Giemsą można wykryć Borrelias sp U pacjentów badających chorobę zwaną gorączką revurrentis. Spiroquettes obserwuje się obficie wśród erytrocytów, w próbkach pobranych w gorączkowym szczycie.
Możliwe jest również wizualizacja bakterii wewnątrzkomórkowych, takich jak Rickettsias sp I Chlamydia trachomatis W zakażonych komórkach.
Parazytologia
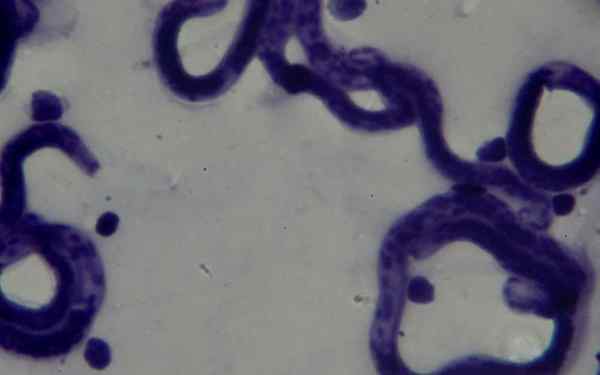
W dziedzinie pasożytologii barwienie Giemsę pozwoliło na diagnozę chorób pasożytniczych, takich jak malaria, Chagas Evil i Leishmanasis.
W pierwszych dwóch pasożytach Plasmodium sp i Cruzi Tripaosoma, odpowiednio można je wizualizować we krwi obwodowej zakażonych pacjentów. Można je znaleźć na różnych etapach zgodnie z fazą, w której choroba jest.
Aby poprawić poszukiwanie pasożytów krwi, jest to zalecane.
Podobnie, skórna leiszmaniza można zdiagnozować podczas oceny próbek skórzanych biopsji barwionych Giemsą, gdzie znaleziono pasożyta.
Cytologia
Barwienie Giemsa jest również stosowane do badania cytologicznego próbek wsierdzia, chociaż nie jest to technika najczęściej stosowana w tym celu.
Ale w przypadku niedoboru zasobów można go użyć, mając funkcjonalność podobną do tej oferowanej przez jezioro Pap i niższy koszt. Wymaga to jednak wiedzy specjalistycznej przez egzaminatora.
Cytogenetyka
Istotną cechą barwienia Giemssy jest jego zdolność do silnego łączenia się z regionami bogatymi w adeniny i timiny DNA. Umożliwia to wizualizację DNA podczas miitozy komórkowej, w różnych stanach kondensacji.
Badania te są niezbędne do wykrycia aberracji chromatycznych, takich jak duplikacje, delecje lub translokacje różnych regionów chromosomów.
 Barwienie Giemsa. Źródło: Panreac Applichem itw Odczynniki. Wersja 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, Hiszpania.
Barwienie Giemsa. Źródło: Panreac Applichem itw Odczynniki. Wersja 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, Hiszpania. Zalecenia dotyczące dobrego barwienia
- Suszenia arkuszy nie powinno być przyspieszane. Ostrożności na jego wysuszenie należy oczekiwać na zewnątrz. Około 2 godziny.
Może ci służyć: Timina- Kolorowanie bezpośrednio po 2 godzinach, aby uzyskać lepsze wyniki.
- Aby zapachy zostały naprawione i farbowane lepiej, próbka musi być rozmieszczona na arkuszu, tak aby była cienka i jednolita warstwa.
- Preferowaną próbką krwi jest kapilara, ponieważ smere.
- Jeśli stosuje się krew żylną, EDTA powinien być stosowany jako antykoagulant, a nie heparyna, ponieważ ten ostatni zwykle deformuje komórki.
Powszechne błędy w zabarwieniu Giemsa
W praktyce tego zabarwienia możesz popełnić błędy. Dowodzą nimi nagłe zmiany tonalności struktur.
Niezwykle niebieskie zabarwienie
Może to wynikać z:
- Bardzo gruba rozmaz.
- Przekraczać czas barwienia.
- Niewystarczająco umyć.
- Stosowanie odczynników znacznie powyżej neutralnego pH (alkaliczna).
W tych warunkach kolory następujących struktur są zniekształcone, w taki sposób, że erytrocyty, zamiast farbowania różowego soli, n będą zielone, granulki eozynofili, które muszą być barwione czerwoną cegłą, stają się niebiesko-szary Gray i tak dalej będzie odchylenie w zwykłych odcieniach.
Nadmiernie różowe zabarwienie
Może to wynikać z:
- Niewystarczający czas barwienia.
- Przedłużone lub nadmierne mycie.
- Słabo suszenia.
- Stosowanie bardzo kwaśnych odczynników.
W tym konkretnym przypadku struktury, które zwykle są barwione na niebiesko, nie będą prawie widoczne, podczas gdy struktury, które są barwione, ponieważ róża będą miały bardzo przesadzone tony.
Przykład: erytrocyty będą przyjmować silny jasny lub pomarańczowy kolor czerwony, chromatyna jądrowa będzie wyglądać na jasnoróżowe, a eozynofilowe granulki zostaną barwione z jasnoczerwonego jasnego jasnego.
Obecność osadów w wymazie
Przyczyny mogą być:
- Użyj brudnych lub złych plasterków.
- Nie pozwól, aby wymaz wyschł.
- Zostaw rozwiązanie mocujące na zbyt długo.
- Nieodpowiednie mycie pod koniec barwienia.
- Nieodpowiednia filtracja lub brak uzdrowniającego barwnika, który jest używany.
Obecność artefaktów morfologicznych
W rozmazach mogą pojawić się artefakty morfologiczne, które utrudniają wizualizację i interpretację obecnych struktur. Jest to spowodowane:
- Rodzaj zastosowanego antykoagulantu, takiego jak heparyna.
- Użycie brudnych, pogorszonych lub tłustej arkuszy.
Tryb przechowywania
Po przygotowaniu barwnik musi być utrzymywany w temperaturze pokojowej (15-25 ° C), aby zapobiec wytrącaniu barwnika. Musi być przechowywany w dobrze zamkniętym bursztynowym pojemniku.
Bibliografia
- Cannova, zm., Brito, e. I Simons, m. (2016). Ocena technik zabarwiania diagnozy skórnej leiszmaniozy. Salus.
- Panreac Applichem itw Regnts. Barwienie Giemsa. Wersja 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, Hiszpania.
- Clark, g. Procedury barwienia (1981). Williams i Willkins.

