Barwienie zarodników
- 2378
- 116
- Gabriela Łuczak
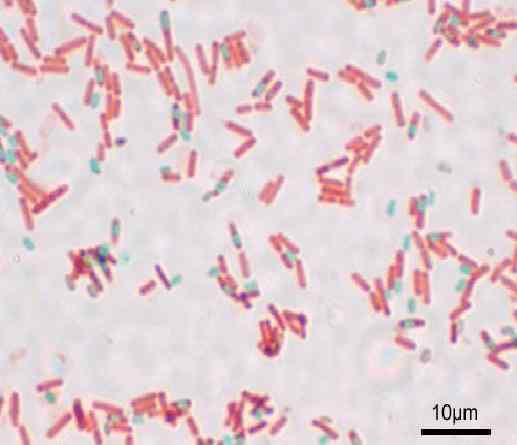
 Barwienie zarodników metodą Shaeffer-Fulton lub Wirtz-Conklin. Źródło: Y także (oryginalny przesyłanie) [GFDL (http: // www.gnu antylopa.Org/copyleft/fdl.HTML) lub CC-be-3.0, Wikimedia Commons
Barwienie zarodników metodą Shaeffer-Fulton lub Wirtz-Conklin. Źródło: Y także (oryginalny przesyłanie) [GFDL (http: // www.gnu antylopa.Org/copyleft/fdl.HTML) lub CC-be-3.0, Wikimedia Commons Jakie jest zabarwienie zarodników?
Barwienie zarodników Jest to metodologia stosowana do pokolorowania struktur oporności, które tworzą niektóre rodzaje bakteryjne, gdy są w niekorzystnych warunkach. Służy do identyfikacji bakterii.
Istnieje wiele gatunków, które tworzą zarodniki, główne są Bakcyl I Clostridium. Te gatunki są uważane za bardziej istotne, ponieważ mają gatunki patogenne dla ludzi.
Każdy Bacillus może powodować zarodniki. W momencie farbowania przygotowania zarodniki można znaleźć w Bacillus (endospora) lub poza tym (Exospora). Z konwencjonalnymi technikami zabarwiania bakterii - takich jak barwienie gramu - zarodniki są bezbarwne.
Obecnie istnieje kilka metod kolorów zdolnych do przekroczenia grubej struktury zarodnika, aby go farbować. Metodologie te są bardzo zróżnicowane, a technika Dornera, Möeller's Garding i Shaeffer-Fulton, znana również jako Wirtz-Conklin.
Ze wszystkich wymienionych technik metodologia Shaeffer-Fulton jest najczęściej stosowana w rutynowych laboratoriach. Zawdzięcza dwóm mikrobiologom, którzy stworzyli zabarwienie w 1930 roku: Alicia Shaeffer i Macdonald Fulton. Czasami jednak technika nazywa się Wirtz-Conklin na cześć dwóch 1900 bakteriologów.
Podstawa
Zarodniki nie są barwione konwencjonalnymi zabarwieniem, ponieważ mają bardzo grubą ścianę. Złożony skład zarodników zapobiega wejściu większości barwników.
Jeśli zarodniki na zewnątrz jest badane do wewnątrz, obserwowane są następujące warstwy: po pierwsze, istnieje egzosporium, które jest najlepszą i najbardziej zewnętrzną warstwą utworzoną przez glikoproteiny.
Następnie pojawia się naskórka, która zapewnia odporność na wysokie temperatury, a następnie kora złożona z peptydoglikanu. Następnie istnieje podstawa podstawy, która chroni protoplast.
Zarodek to odwodniona struktura, która zawiera 15% kwasu wapnia i kwasu dipykolinowego. Dlatego większość technik zabarwiania zarodników opiera się na zastosowaniu ciepła, dzięki czemu barwnik może przeniknąć do grubej struktury.
Może ci służyć: laktogeneza: cechy i stadiaPo zabarwieniu zarodników nie może wyeliminować barwnika. W technice Shaeffer-Fulton zielony Malachite wchodzi w komórki wegetatywne i, stosując ciepło, przenika do Endospora.
Podczas mycia wodą barwnik jest usuwany z komórki wegetatywnej. Dzieje się tak, ponieważ zielony barwnik malachite jest nieco podstawowy, więc komórka wegetatywna wiąże się słabo.
Zamiast tego nie możesz wydostać się ze zarodników i wreszcie zatrudnia się Bacillus z safraniną. Ta podstawa jest ważna dla reszty technik, w których dzieje się coś podobnego.
Zarodowi techniki zabarwienia
Aby wykonać barwienie zarodników, musisz mieć czysty upraw podejrzanego szczepu, którego chcesz się uczyć.
Uprawa jest poddawana ekstremalnym temperaturom przez 24 godziny w celu stymulowania mikroorganizmu do sporowanego. W tym celu uprawa można umieścić w 44 ° C lub w lodówce (8 ° C) na 24 lub 48 godzin.
Jeśli odejdziesz zbyt długo w wyżej wymienionych temperaturach, będą obserwowane tylko egzospury, ponieważ wszystkie endospory zostawią Bacillus.
Kulminowany czas, należy umieścić kilka kropli sterylnego roztworu fizjologicznego na czystym slajdzie. Wtedy pobrana jest niewielka część upraw i przedłużona grzywna.
Następnie może wysychać, jest przymocowany do ciepła i farbowania niektórymi technikami wyjaśnionymi poniżej:
Technika Dornera
- Przygotuj w probówce stężone zawieszenie mikroorganizmu sporowane w wodzie destylowanej i dodaj równą objętość Fenicada Fuchsina z Kinyoun filtrowanych.
- Umieść rurkę w kąpieli z wrzącą wodą przez 5 do 10 minut.
- Na czystym szkiełku wymieszanym kroplem poprzedniego zawieszenia z kroplą wodnego roztworu nigrozyny na 10%, gotowane i filtrowane.
- Wyciągnij i wysusz z miękkim ciepłem.
- Zbadaj za pomocą celu 100x (zanurzenie).
Zarodniki są barwione czerwone, a komórki bakteryjne wydają się prawie bezbarwne na ciemnoszarym tle.
Może ci służyć: Helminology: pochodzenie, jakie badania, przykład badańZmodyfikowana technika Dornera
- Wydłużony zawieszenie sporulowanego mikroorganizmu jest wytwarzany na szkiełku i przymocowany do ciepła.
- Próbka jest pokryta paskiem papieru filtracyjnego, do którego dodaje się Fenicada Fuchsin. Barwnik jest podgrzewany od 5 do 7 minut z płomieniem zapalniczki Bunsena, aż wygeneruje się oderwanie pary. Następnie papier jest wycofany.
- Przygotowanie z wodą jest myte, a następnie wysycha pochłaniającym papierem.
- Rozmaz jest pokryty cienkim filmem o 10%nigrozyny, przy użyciu drugiego slajdu do przedłużenia nigrozyny lub igły.
Zabarwienie pobrane przez zarodniki i bakterie jest równe opisaniu w poprzedniej technice.
Technika Shaeffer-Fulton lub Wirtz-Conklin
- Wyciągnij grzywnę z zawieszeniem sporulowanego mikroorganizmu na zjeździe i naprawić ciepło.
- Przykryj szkiełko wodnym zielonym roztworem Malachite na 5% (na arkuszu można umieścić bibułę filtracyjną).
- Ogrzewać płomienie zapalniczki Bunsena, aż spowoduje oddział pary i usuń płomień. Powtórz operację od 6 do 10 minut. Jeśli podczas zabiegu Malachite Green Solution odparowuje więcej, można dodać więcej.
- Zdejmij bibułę filtracyjną (jeśli umieszczono) i umyj wodą.
- Przykryj szkiełka 0,5% wodną safraniną przez 30 sekund (niektóre warianty techniki wykorzystują 0,1% wodną safraninę i pozostaw ją na 3 minuty).
Z tą techniką zarodniki są prezentowane zielone i czerwone pachilli.
Ma niedogodności, że endospory młodych upraw nie są dobrze barwione, ponieważ wyglądają wyjątkowo wyraźnie lub bezbarwnie. Aby tego uniknąć, zaleca się stosowanie 48 -godzinnej inkubacji upraw.
Technika Möeller
- Przykryj rozmaz chloroformem przez 2 minuty.
- Odrzuć chloroform.
- Pokrycie 5% kwasem chromowym przez 5 minut.
- Umyj wodą destylowaną.
- Arkusz z karbolem Fuchsyna-Fenicada jest pokryty i wystawiony na płomień Bunsena zapalniczki aż do emisji opar. Operacja jest powtarzana do 10 minut.
- Umyj wodą.
- Do przebarwienia użyj zakwaszonego etanolu (alkohol solny). Pozostaje na 20 lub 30 sekund.
- Umyj wodą destylowaną.
- Zatrudnij arkusz błękitem metylenowym przez 5 minut.
- Umyj wodą destylowaną.
- Można wysychać i zabrać próbkę do mikroskopu.
Zarodniki wyglądają na czerwono, a niebieskie bachilli. Ważne jest, aby nie aspirować do oparów, ponieważ są one toksyczne i długoterminowe, mogą być rakotwórcze.
Technika Möeller zmodyfikowana bez ciepła
W 2007 roku Hayama i jego współpracownicy stworzyli modyfikację techniki Möellera. Wyeliminowali barwnik barwnika i zastąpili go dodaniem 2 kropli środka powierzchniowo czynnego tergitolu 7 na każde 10 ml roztworu karbolowego feniowanego fuksyna. Te same wyniki uzyskano.
Aplikacje
Zabarwienie zarodników zapewnia bardzo cenne i przydatne informacje do identyfikacji patogenu, ponieważ obecność tego samego, jego kształtu, lokalizacji w Bacillus i zdolność do deformowania ogniwa wegetatywnego lub nie, są danymi, które mogą kierować gatunkiem, które mogą kierować gatunkiem gatunek zaangażowany w pewnej płci.
W tym kontekście warto powiedzieć, że zarodniki mogą być okrągłe lub owalne, mogą znajdować się w środku lub także w pozycji blansowej, substeralnej lub końcowej.
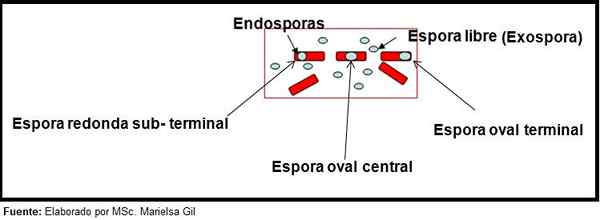 Schemat formy i pozycji endosporów i egzospora
Schemat formy i pozycji endosporów i egzospora Przykłady
- Clostridium difficile Tworzy owalny zarodek w końcowej pozycji, która deformuje Bacillus.
- Zarodniki Clostridium Tertium Jest owalny, nie odkształca Bacillus i znajduje się na poziomie końcowym.
- Endospora Clostridium Tetani Jest terminal i deformuje Bacillus, co daje wygląd bębna.
- Zarodniki Clostridium botulinum, C. histoliticum, C. Novy I C. Septicum Są okrągłe lub owalne, podziemne i deformują Bacillus.
- Endospora Clostridium sordelli Znajduje się w pozycji centralnej, z lekkim deformacją.
Bibliografia
- Struda Moellera. Odzyskane z.Wikipedia.org.
- Endospora. Odzyskane z ES.Wikipedia.org.
- Forbes, ur., Sahm, d., Weissfeld, a. Diagnoza mikrobiologiczna Bailey & Scott. Pan -american Editorial S.DO.

