Kwasowe bazy arrhenius, teorie Bronsted-Lowry, Lewis

- 1278
- 145
- Prokul Woliński
 Wykres, który odnosi trzy główne teorie kwasów i zasad. Źródło: TEM5PSU, CC BY-SA 3.0, Via Wikimedia Commons
Wykres, który odnosi trzy główne teorie kwasów i zasad. Źródło: TEM5PSU, CC BY-SA 3.0, Via Wikimedia Commons Jakie są teorie kwasowe i podstawowe?
Teorie kwasu i podstawy są zestawem wkładów koncepcyjnych, które definiują i różnicują kwasy i zasady, dwa konglomeraty o ogromnych substancjach dotyczących znaczenia w dziedzinach chemii.
Jego korzenie pochodzą z pierwszych charakterystyk wykonanych przez Roberta Boyle'a w 1661 r., Który zdefiniował kwasy, takie jak substancje kwaśne i korozyjne, które zmieniają kolor niebieskiego na czerwony papier wiosenny; I podstawy, takie jak substancje mydlane, które w przeciwieństwie do kwasów zmieniają kolor czerwonego na błękitne goleniowe papier.
Antoine Lavoisier zaproponował, że wszystkie kwasy zawierają atomy tlenu, takie jak H2południowy zachód4 i Hno3. Wieki później w 1811 r. Humphry Davy odkrył, że wiele kwasów faktycznie nie posiadało atomów tlenu, takich jak HCL, HF, HBR itp.
I na krótko przed pojawieniem się słynnej triady kwasowo-zasadowej (obraz doskonałego), Justig Liebig zasugerował, że kwasy mają atomy wodoru, które można zastąpić kationami metalowymi.
Ta wiedza empiryczna służyła jako inspiracja dla obecnych teorii kwasów i podstaw: Arrhenius, Bronsted-Lowry i Lewis. Jak widać na wykresie, teoria Arrheniusa jest najbardziej restrykcyjna lub ograniczona, podczas gdy Lewis jest najbardziej ogólny i zglobalizowany.
Teoria Arrheniusa
Zaproponowany przez Svante Arrhenius z 1884 r., Jego teoria mówi, że kwasy po rozpuszczeniu w wodzie wytwarzają jony3ALBO+ lub h+; Podczas gdy podstawy, podczas rozpuszczania się w wodzie, produkują lub uwalniają jony-.
Jony h3ALBO+ I och- Łączą się w odwracalnej reakcji, która powoduje powstanie cząsteczek wody:
H3ALBO+ + Oh- ⇌ 2H2ALBO
Może ci służyć: kwas disulfurowy: co to jest, struktura, właściwości, używaTak więc kwas Arrheniusa jest również tym, który zwiększa stężenie jonów H3ALBO+, Podczas gdy podstawa Arrheniusa jest taka, która zwiększa stężenie jonów-.
Oznacza to, że kwas Arrhenius niekoniecznie powinien zawierać ję3ALBO+, A baza Arrheniusa nie musi mieć jonów OH- W swojej strukturze.
Przykład i ograniczenia
Rozważ następujące dysocjacje:
HCl (AC) → H+(AC) +Cl-(AC)
Naoh (ac) → na+(AC) +OH-(AC)
HCl jest kwasem Arrhenius, ponieważ gdy jest rozpuszczony w wodzie, wytwarza h jony+, lub bardziej poprawnie, h jony3ALBO+. A z drugiej strony NaOH jest podstawą Arrheniusa, ponieważ gdy jest rozpuszczona w wodzie, jony OH uwalniają-. Substancje te reagują na siebie, wytwarzając sól i wodę:
HCl (AC) + NaOH (AC) → NaCl (AC) + H2ALBO
Problem z teorią Arrheniusa polega na tym, że jest ona ograniczona tylko do roztworów wodnych, a zatem dotyczy tylko substancji, które są rozpuszczalne w wodzie. Na przykład MGO jest bardzo nierozpuszczalne w wodzie, a jednak jest podstawowym tlenek.
Nie jest również w stanie wyjaśnić sobie, w jaki sposób substancje takie jak NH3 i Cao produkują jony- rozpuszczone w wodzie, nawet jeśli nie mają jonów oh- W swojej strukturze molekularnej lub krystalicznej (tak jak w przypadku NaOH lub KOH).
I nie wyjaśnia, w jaki sposób CO2 może wydać jony h3ALBO+ W wodzie bez żadnego atomu wodoru w jego strukturze molekularnej (jak ma to miejsce w przypadku HCl lub H2południowy zachód4).
Brönsted-Lowry Theory
Propozycja indywidualnie w 1923 r. Johannesa Bronsteda i Thomasa Lewry'ego, ich teoria kwasów i zasad mówi, że kwas jest wszystkim, co substancja, która może przekazać jony h+, i że baza jest zamiast tego jak dowolna substancja, która jest w stanie zaakceptować te h+. Teoria ta jest bardziej ogólna niż teoria Arrheniusa i obejmuje kilka jej ograniczeń.
Może ci służyć: Rozwiązania molowe: koncepcja, przygotowanie, przykładyPrzykład
Rozważ ponownie równanie neutralizacji między H3ALBO+ I och- Wytworzyć dwie cząsteczki wody:
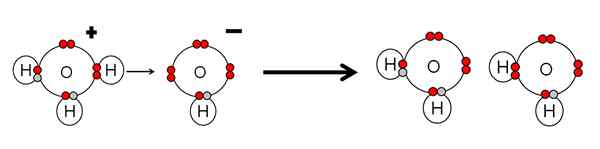 Przykład neutralizacji kwasu i podstawy wody. Źródło: Gabriel Bolívar.
Przykład neutralizacji kwasu i podstawy wody. Źródło: Gabriel Bolívar. Zwróć uwagę, że h3ALBO+ Zrobiłem h+ które natychmiast będą połączone lub skoordynowane z OH- Right -right. Kiedy h+ Kończy się połączeniem z jedną z par elektronowych OH-, Dwie neutralne cząsteczki wody pozostają jako produkty.
H3ALBO+ Dlatego jest to kwas Brnsted-Lowry, za przekazanie H+, I och- Jest to baza Brnsted-Lowry do zaakceptowania tego h+.
Kolejny przykład reakcji kwasowo-zasadowej jest następujący:
NH3(g) + HCl (g) → NH4Cl (s)
Tę reakcji, według Arrheniusa, nie można było uznać za typ kwasowo-zasadowy, ponieważ nie ma miejsca w pożywce wodnej, ale w fazie pary lub w stanie gazowym. NH3 Jest to podstawa BRNSTED, ponieważ akceptuje HCl H, przekazując kilka elektronów znajdujących się na atomie azotu; A HCL, logiczne, staje się kwasem Brnsted.
Zatem MGO jest bazą Brnsteda, ponieważ jest w stanie zaakceptować h+ kwasów do przekształcenia w mg (OH)2.
Teoria Lewisa
Teoria Bronsteda-Lowry wyjaśnia szerokie spektrum reakcji kwasowo-zasadowych. Zignoruj jednak te reakcje, w których jony H+ I och- W ogóle nie są zaangażowane, a także większy udział wolnych elektronów w mechanizmach molekularnych.
Tak więc w 1923 g. N. Lewis zaproponował teorię kwasowo-zasadową, która mówi: kwas to dowolna substancja, która jest zdolna do przyjmowania par elektronów, podczas gdy podstawa to ta, która przekazuje te pary elektronów.
Może ci służyć: Dapi (4 ', 6-diamidino-2-fenyloindol): Charakterystyka, fundament, użycieNa przykład Ion H+ Jest to kwas Lewisa, ponieważ akceptuje pary elektronów dowolnego gatunku: od H2Lub pochodzić H3ALBO+, NH3 Począć NH4+, itp.
Przykład i zalety
Rozważ inny przykład w następującej reakcji:
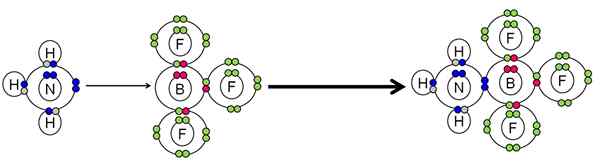 Przykład neutralizacji między kwasem a zasadą Lewisa. Źródło: Gabriel Bolívar.
Przykład neutralizacji między kwasem a zasadą Lewisa. Źródło: Gabriel Bolívar. NH3 Wykonano parę elektronów (niebieski) atomu azotu do atomu boru BF3. Dlatego NH3 Jest to podstawa Lewisa, ponieważ przekazuje parę elektronów i BF3 To kwas Lewisa, ponieważ ich akceptuje.
Ogólnie rzecz biorąc, gatunki kationów i biednych elektronów są kwasami Lewisa, podczas gdy aniony i gatunki energii elektronowej są bazami Lewis.
Oferowane zalety.
Na przykład: H2O ma wolne elektrony w tlenu. Jeśli przekazasz jeden z nich na jon h+, będzie działać jak baza Lewisa, będąc H+ W konsekwencji kwas Lewisa.
Według Bronsted-Lowry, H2Albo działałbym jako baza, ponieważ precyzyjnie akceptuje H+ Przekazując kilka ich bezpłatnych elektronów. I wreszcie H2Lub jest to również podstawa według teorii Arrheniusa, ponieważ stężenie jonów H maleje+ w środowisku wodnym, a w konsekwencji zwiększenie stężenia jonów OH-.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Clark Jim. (2002). Teorie kwasów i podstaw. Odzyskane z: chemguide.współ.Wielka Brytania
- Broderick c., Moussa m., I Clark J. (21 sierpnia 2020). Przegląd kwasów i podstaw. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Wikipedia. (2020). Reakcja kwasowo-zasadowa. Źródło: w:.Wikipedia.org
- Texas A&M University. (S.F.). Kwasy i zasady: rozwój kwasów i zasad. Odzyskane z: chem.Tamu.Edu

