Link mostu wodoru
- 1220
- 118
- Estera Wojtkowiak
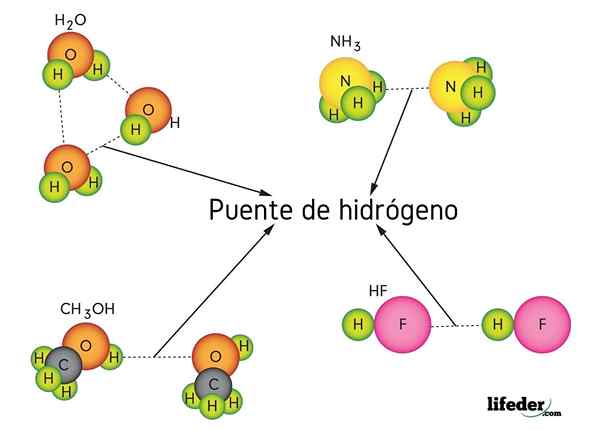
 Wodorowy mostek w wodzie (h2O), metanol (cho3OH), fluor wodorowy (HF) i amoniak (NH3)
Wodorowy mostek w wodzie (h2O), metanol (cho3OH), fluor wodorowy (HF) i amoniak (NH3) Co to jest link do mostu wodorowego?
Wiązanie mostka wodoru jest specjalnym rodzajem interakcji dipol-dipolo, należących do sił Van der Waalsa, w którym atom wodoru łączy dwie lub więcej cząsteczek bez kowalencyjnego połączenia. Nie ma mowy o przedziale elektronowym, ale głównie zjawisko elektrostatyczne.
Jak sama nazwa wskazuje, wodór działa jak most, więc musi być między dwoma atomami. Wodór jest połączony (H-X) z bardzo elektroonegatywnym atomem (takim jak N, O i F) i zbliża się do innego atomu elektroonegatywnego, ale z sąsiedniej cząsteczki. Powoduje to powstawanie mostu wodorowego X ··· H-X.
Zauważ, że w reprezentacji x ··· x punkty symbolizują most wodoru, podczas gdy skrypt reprezentuje kowalencyjne wiązanie między H i x. To powiedziawszy, spójrzmy na mostku wodoru między dwiema cząsteczkami wody, gdzie x jest atomem tlenu: h2Lub ··· H-OH (niższy obraz).
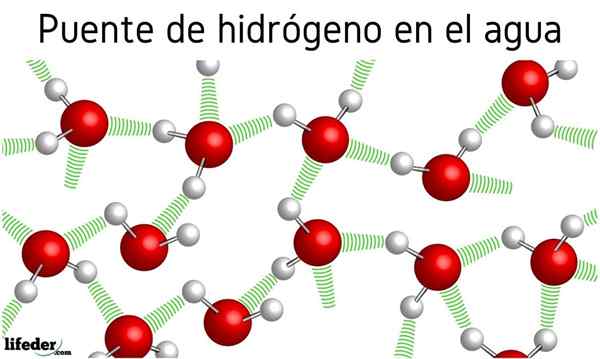
Na powyższym zdjęciu widzimy, że siedem cząsteczek wody pozostaje razem dzięki ich mostom wodorowym, reprezentowanym przez niebieskie linie. Sam mostek wodoru nie jest zbyt silny, ale gdy są ich miliardy, dają materię nienormalne i nieoczekiwane właściwości.
Charakterystyka mostu wodorowego
Kompozycja
Mostor wodoru powinien być naprawdę reprezentowany jako x '··· H-X, gdzie x jest tak zwanym dawcą mostu wodoru, ponieważ jest kowalencyjnie powiązany z wodorem (daje).
Tymczasem x 'jest akceptorem mostu wodorowego, obecnego w sąsiedniej cząsteczce (odbiera ją). Zatem mamy atom dawcy (x), wodór (h) i atom akceptora (x ') tworzący mostku wodoru (x' ··· h-x).
Geometryczny
Kiedy myślimy o moście, płaskich lub łukowych, przychodzą mi do głowy powierzchnie. Ponieważ zakłada się, że łącza nie krzywą, będziemy mieć dwie odległości: x ··· h i h-x, które tworzą most wodorowy x ··· h-x.
Może ci służyć: nieodwracalna reakcja: cechy i przykładyPomiędzy tymi dwiema odległościami występuje kąt, który często wynosi 180 °; To znaczy trzy atomy naszego mostu spoczywają na tej samej poziomej (lub pionowej) linii.
Gdy kąt różni się od 180º, most x ··· H-X nie jest już prosty ani liniowy, ale nabywa inne geometrie.
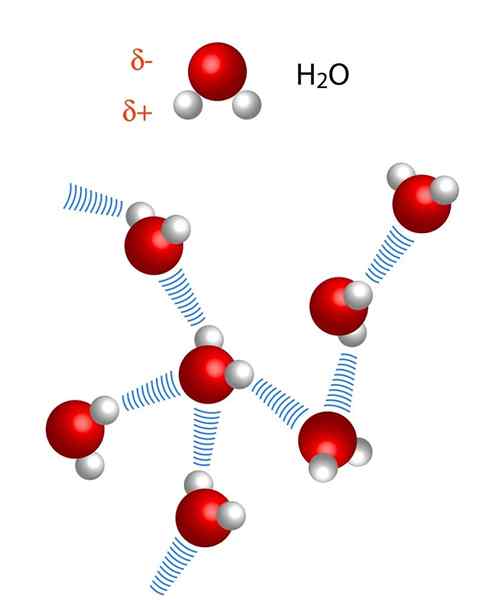
Z drugiej strony odległości mostów wodorowych nie są identyczne. Odległość H-X jest krótsza niż x ··· h, co można zobaczyć na obrazie cząsteczek wody. Zatem na przykład odległość H-X wynosi zwykle 110 pM (1,10-12m), podczas gdy druga odległość x ··· H jest 160 pm dalej.
Asocjacyjny
Szczególną cechą mostu wodorowego jest to, że pozwala on być bardziej powiązanym ze sobą cząsteczek. Nie chodzą z boku na drugie, ignorując się. Dlatego ustanawia momentowy porządek w piersi płynów; Aw przypadku ciał stałych przyczyniają się do definicji swoich kryształów.
Gdzie widzimy most wodorowy.
Energia
Łamanie mostu wodoru nie jest zbyt trudne. Cząsteczki wody, na przykład, chodź i tworzenie za każdym razem podczas mobilizacji. Ale złamanie wielu z nich jednocześnie oznaczałoby niekończącą liczbę cząsteczek. Mówimy o dostarczaniu takiej energii, która łamie mole z tych mostów wodoru (6.02 · 1023 X ··· H-X).
Zatem siła mostu wodoru zmienia się w zależności od tożsamości i natury cząsteczek. Na przykład siła mostu wodorowego lub ··· · H-O między wodą a alkoholem wynosi 5 kcal/mol: 5 kcal energii, aby złamać kret tego mostu wodoru, o którym mowa.
Może ci służyć: zmiany chemiczne: cechy, przykłady, typyPrzykłady mostów wodorowych
Woda
Początkowo rozmawiano o mostach wodorowych między cząsteczkami wody, ale nie wspomniano o ich właściwościach. Dzięki im woda gotuje się w temperaturze 100 ° C, pozostawiając temperaturę wrzenia pokrewnych cząsteczek, takich jak H2S, który gotuje się przy -60 ° C; lub h2Wiem, gotuj na -41.25 ° C.
Ta fatalna różnica wynika z mostów wodorowych wodnych, które również definiują inne ich anomalne właściwości, takie jak ich ogromne ciepło właściwe, kryształy lodu, ich stała dielektryczna itp.
Etanol
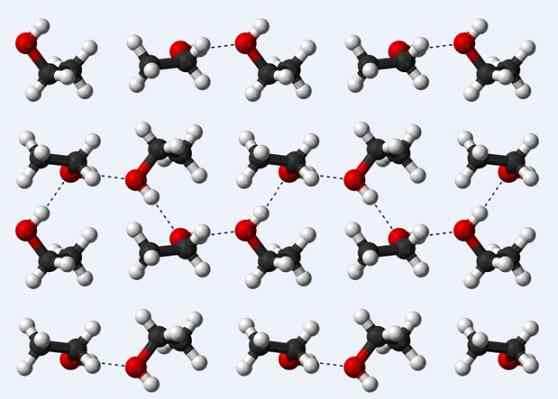 Mosty wodorowe w krysztale etanolu
Mosty wodorowe w krysztale etanolu Teraz zobaczmy kolejny most wodorowy: ten między cząsteczkami etanolu, CH3Ch2Och (powyżej). Zwróć uwagę, jak zakwaterowane są cząsteczki3Ch2Och, w taki sposób, że ich mosty wodorowe są ustalane3Ch2Ho ··· Hoch2Ch3 (kropkowane linie).
Jednak cząsteczki są zbyt uporządkowane, aby założyć, że mówimy o płynnym etanolu, ale zamiast tego tworzymy szkło (stały etanol).
Mostka wodoru opisana dla etanolu jest podobna do wydajności innych alkoholi, z różnicą, że ich gazowane szkielety mogą utrudniać wydajność wspomnianych mostów.
Kwas octowy
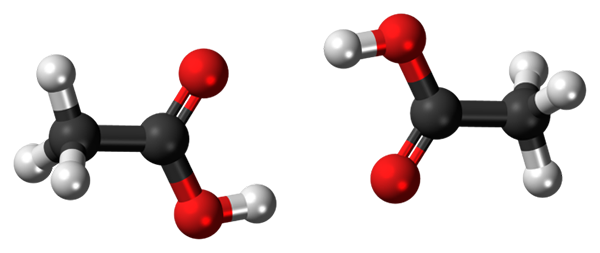 Mosty wodorowe między dwiema cząsteczkami kwasu octowego. Źródło: Jynto, CC0, Via Wikimedia Commons
Mosty wodorowe między dwiema cząsteczkami kwasu octowego. Źródło: Jynto, CC0, Via Wikimedia Commons Kwas octowy, cho3COOH, jest w stanie ustalić dwa mosty wodorowe, które jednoczą dwie cząsteczki. Ponieważ są to dwie cząsteczki połączone mostami wodorowymi, mówimy o dimeru.
Należy zauważyć, że jednym z tych mostów wodorowych jest C = O ··· H-O, a drugi O-H ··· O = C. Kwas octowy przedstawia osobliwość, że w fazie pary istnieje jak ten dimer.
Może ci służyć: manganiczny lub kwas nadmanżowyCeluloza
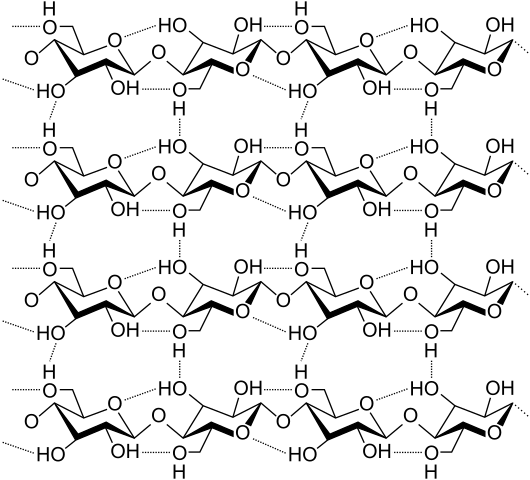 Mosty wodorowe między kilkoma łańcuchami celulozowymi. Źródło: Laghi.L, CC BY-SA 3.0, Via Wikimedia Commons
Mosty wodorowe między kilkoma łańcuchami celulozowymi. Źródło: Laghi.L, CC BY-SA 3.0, Via Wikimedia Commons Zobaczmy teraz bardziej różnorodne i wiele mostów wodorowych. Celuloza, naturalny polimer, składa się z łańcuchów złożonych z kilku jednostek β-glukozy.
Każdy łańcuch pozostaje przymocowany do wielu mostów wodorowych (obraz doskonały), które wzmacniają spójność między łańcuchami.
DNA
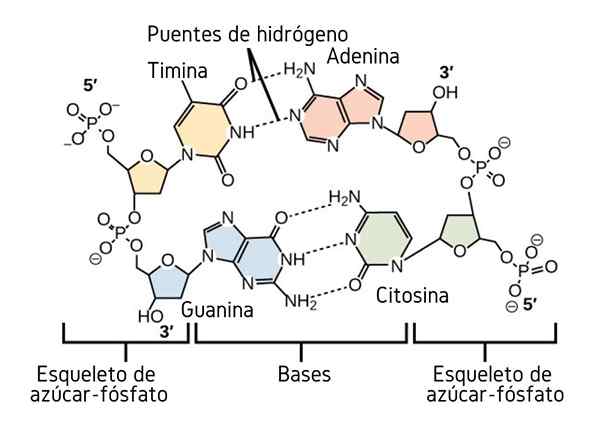 Mosty wodorowe między zasadami azotu DNA. Źródło: CNX OpenStax, CC przez 4.0, Via Wikimedia Commons
Mosty wodorowe między zasadami azotu DNA. Źródło: CNX OpenStax, CC przez 4.0, Via Wikimedia Commons Do tej pory widzieliśmy asocjacyjny działanie mostów wodorowych na nałożenie porządku między cząsteczkami. Ale co z makrocząsteczką? W makromolekule, takiej jak DNA, znajdujemy wewnętrzne lub wewnątrzcząsteczkowe mosty wodorowe między jej tyminą, adeniną, guaniną i cytozyną (powyżej) zasady (powyżej).
Wewnątrzcząsteczkowe mosty wodorowe między tymi parami azotu, sprawiają, że cząsteczka DNA nabywa podwójną strukturę śmigła, która jest idealna do replikacji. Jeśli te mosty wodoru zostaną zepsute przez ogrzewanie, podwójny śmigło zakończy się otwarciem w dwóch poszczególnych segmentach lub pasmach.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Edward e. Ávila i Asilé J. Jeżyna. (2004). Most wodorowy i jego zastosowania łączą. University of Los Andes, Wydział Naukowy, Wydział Chemii.
- Wikipedia. (2020). Wiązanie wodorowe. Źródło: w:.Wikipedia.org
- Pietri J. I Clark J. (21 sierpnia 2020). Wiązanie wodorowe. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Redaktorzy Enyclopaedia Britannica. (2020). Wiązanie wodorowe. Odzyskane z: Britannica.com
- Helmestine, Anne Marie, pH.D. (29 października 2020). Jaki jest przykład wiązania wodorowego? Odzyskane z: Thoughtco.com

