Struktura bromku potasu (KBR) właściwości,
- 3671
- 421
- Eliasz Dubiel
On Bromid potasowy Jest to sól nieorganiczna, której wzorem chemicznym jest KBR. Powstaje przez elektrostatyczne zjednoczenie anionu bromek, br-, I kation potasowy, k+, w proporcji 1: 1; to znaczy, mamy taką samą ilość BR- od k+ W kryształach KBR.
Bromid potasowy jest solidną białą lub krystaliczną solą, jest bezwonny, bardzo rozpuszczalny w wodzie i niewielki rozpuszczalny w etanolu i etanolu. Został użyty w ostatniej części XIX wieku i znacznej części XX wieku w leczeniu padaczki i jako uspokajający.
Do 1975 r. Obecnie jest nadal stosowany u kilku gatunków zwierząt w leczeniu napadów, chociaż od 1912 r. Zastąpiło go fenobarbital sodu.
Bromid potasowy jest wykorzystywany w badaniach optycznych odpowiadających pobliskim obszarze podczerwieni widma elektromagnetycznego. Służy również jako materiał używany w dziedzinie fotografii.
[TOC]
Typ linku
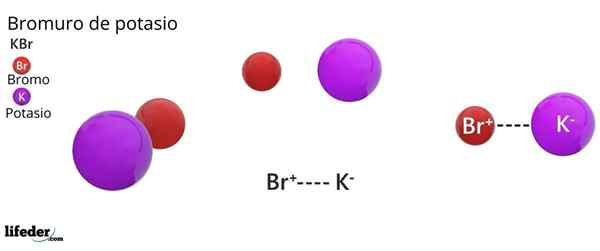
Bromid potasowy jest solą binarną, produktem kombinacji atomu bromu ze stanem utleniania -1, z atomem potasu ze stanem utleniania +1. Dlatego ustalono przyciąganie elektryczne między jonem BR- I K -Ion+.
Ten rodzaj interakcji elektrycznej lub elektrostatycznej jest znany jako wiązanie jonowe, które dysocjuje, gdy sól bromku potasu rozpuszcza się w wodzie, uwalniając jony k+ i br-.
Te jony są rozpadane przez właścicieli wody.
Struktura bromku potasu
 Struktura krystaliczna FCC KBR: brązowe kule odpowiadają BR-, podczas gdy sferki fioletowe odpowiadają kationom k+
Struktura krystaliczna FCC KBR: brązowe kule odpowiadają BR-, podczas gdy sferki fioletowe odpowiadają kationom k+ Bromid potasowy przedstawia sześcienną strukturę krystaliczną wyśrodkowaną na twarzy (FCC) Centeererder-Centersed Cubic), równe obserwowanemu w chlorku sodu.
Może ci służyć: Faraday ConstantW tej strukturze każdy anion BR- Jest połączony lub koordynowany z sześcioma Krontami+, A z kolei każdy k+ Ma sześć BR- Jako sąsiedzi w krystalicznych sieciach.
Nomenklatura
Bromek potasowy jest klasyfikowany jako halogenek halogenkowy lub alkaliczny. Nazwy tych soli są zbudowane przez wyeliminowanie ostatecznej litery o nazwie halogenu (chlor, brom, jod, fluor i astato), z wyjątkiem fluoru, i zastąpienie końcowej litery na sufiks -uro. Nazwa metalu jest napisana poniżej bez modyfikacji.
Na przykład: chlorek sodu, jodek potasu, fluor wapnia itp. Dlatego KBR nazywa się bromkiem potasu lub bromkiem potasu (zgodnie z tradycyjną nomenklaturą).
Właściwości bromku potasu
 Dysk zegara z granulami KBR. Źródło: Walkerma przez Wikipedia.
Dysk zegara z granulami KBR. Źródło: Walkerma przez Wikipedia. Wygląd fizyczny
Bezbarwne szkło, krystaliczne lub białe granulki.
Zapach
Toaleta
Smak
W wysokiej koncentracji ma gorzki i pikantny smak.
Masa cząsteczkowa
119.02 g/mol
Gęstość
2.74 g/cm3 w 25 ° C
Temperatura topnienia
734 ºC
Punkt wrzenia
1435 ° C
Rozpuszczalność wody
535 g/l A 0 ºC
678 g/l 25 ° C
1020 g/l A 100 ºC
1 gram soli rozpuszcza się w 1 ml wrzącej wody, co wskazuje, że jest ona bardzo rozpuszczalna w wodzie.
Rozpuszczalność w glicerolu
217 g/l
1 gram bromku potasu rozpuszcza się w 4.6 ml glicerolu.
Rozpuszczalność etanolu
47.6 g/l 80 ° C.
1 gram bromku potasu rozpuszcza się w 250 ml etanolu.
Gęstość pary
7.14 w relacji powietrznej traktowanych jako jednostka.
Stabilność
Stabilne, jeśli są przechowywane w zalecanych warunkach. Niezgodne z środkami utleniającymi, silnymi kwasami, bromem trifluorku i bromem.
Rozkład
Po podgrzaniu do rozkładu emituje szkodliwe produkty, takie jak bromek wodoru i tlenek potasu.
Może Ci służyć: Elektroniczna konfiguracja jądra: konstrukcja, przykładyWskaźnik refrakcji (ND)
1.559
Ph
W roztworze wodnym wytwarza neutralne pH, około 7.
punkt zapłonu
1435 ° C
Rozpuszczanie i reaktywność
W roztworze wodnym KBR jest całkowicie zdysocjowany, aby spowodować neutralny roztwór pH.
Sól jest źródłem bromku, które można wykorzystać do produkcji bromku srebrnego, AGBR, związek stosowany w rozwoju zdjęć:
KBR (AC) +Agno3 (AC) → AGBR (s) +KNO3 (AC)
Ponadto KBR jest słabym środkiem redukującym, niezgodnym z soleami rtęci i srebrnymi. Powoduje gwałtowną reakcję z bromem trifluorku. Może reagować z wieloma solami, alkaloidami i skrobią.
Reaguje również z kwasami, na przykład ze stężonym kwasem siarkowym, uwalniając bromek wodoru.
Aplikacje
Leczenie epilepsji i napadów
Sir Charles Locock po raz pierwszy ujawniono właściwości przeciwdrgawkowe bromku potasu, na spotkaniu Medycyny Królewskiej i Chirurigical Society w 1857 r., Które promowało jego stosowanie w leczeniu padaczki.
Bromid potasowy zastosowano jako priorytetowy lek w leczeniu padaczki i jako środek uspokajający do 1912 r., Kiedy ogłoszono fenobarbital sodu.
Mimo to nadal był stosowany jako uzupełnienie fenobarbitalu sodu w leczeniu napadów padaczki.
W 1975 roku, ze względu na jego toksyczny charakter, FDA U.S. (Food & Drug Administration) postanowił nie zalecać stosowania bromku potasu, zarówno u ludzi, jak i zwierząt. Jednak niektóre kraje nadal to zarządzały.
Bromid potasowy zastosowano jako hipnotyczny i uspokajający u bydła, konie, owce i świń. Zastosowano go również w leczeniu kolki i tetanii u koni oraz w leczeniu napadów u psów.
Optyka na podczerwień
Ze względu na przezroczystość bromku potasu w zakresie długości fali między światłem ultrafioletowym a bliską podczerwień jest używany jako składnik okien dla kilku promieniowania elektromagnetycznego, zwłaszcza promieniowania w podczerwieni.
Może ci służyć: osmolowośćW tym względzie stosuje się kilka technik. Jeden z nich polega na opracowaniu dwóch krystalicznych dysków bromku potasowego, umieszczając film z materiału do analizy w podczerwieni w albumach. Badania są przeprowadzane w bliskiej podczerwieni między 780 nm a 3000 nm.
Fotografia
 KBR był częścią materiałów używanych do przetworzenia pierwszych zdjęć XX wieku
KBR był częścią materiałów używanych do przetworzenia pierwszych zdjęć XX wieku Bromide potasowe miał na przykład wiele zastosowań i zastosowań w fotografii: został użyty do sformułowania programistów fotografii, w produkcji filmów fotograficznych, jako grubości filmu, a także koloru koloru w kolorze.
Jest stosowany w poprawie różnicowania między kryształami halogenów srebra odsłoniętych i nie odsłoniętych, we wzroście gęstości drukowania cienkich negatywów, a jako wtórny halogenek, w połączeniu z jodowcami, do przetwarzania negatywnego papieru na papierze.
Zastosowano go również w połączeniu z bichlorekem rtęci, siarczanu miedzi lub ferricianurio potasu w trybunach fotograficznych. Służył również jako ogranicznik w alkalicznych deweloperach używanych do płyt żelatynowych i dokumentach rozwojowych.
Analiza chemiczna
KBR jest wykorzystywany do określania oceny miedzi i srebra, w analizie polarograficznej indyjskiej, kadmu i arsenu.
Inne zastosowania
Jest stosowany w procesach grawerowania litografii, w przetwarzaniu oleju, w stabilizacji termicznej nylonu, w produkcji włókien, a wreszcie w produkcji specjalnych mydeł.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Dzień, r., & Underwood, a. (1986). Ilościowa chemia analityczna (Ed.). Pearson Prentice Hall.
- Wikipedia. (2020). Bromid potasowy. Źródło: w:.Wikipedia.org
- National Center for Biotechnology Information. (2021). Bromid potasowy. Podsumowanie Pubchem Comunund dla CID 253877. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- EMEA. (1999). Bromide, sól potasowa: Raport podsumowujący. [PDF]. Odzyskane z: EMA.Europa.UE
- Sevier b.V. (2020). Bromid potasowy. Scientedirect. Pobrano z: Scientedirect.com

