Słaby kwas
- 4525
- 1127
- Matylda Duda
 Słabe przykłady kwasu
Słabe przykłady kwasu Co to jest słaby kwas?
Słaby kwas to taki, który w roztworze wodnym ma niewielką zdolność do dysocjacji w wodorze (h+) i w odpowiedniej bazie sprzężonej. W przeciwieństwie do silnych kwasów, których dysocjacja jest kompletna (100%) i praktycznie nieodwracalne, słabe kwasy są ledwo zdysocjowane i odwracalne.
Dlatego słaby kwas generuje mniej hones h+ W wodzie tego, czego można się spodziewać. Wśród najbardziej reprezentatywnych słabych kwasów mamy kwas octowy, główny składnik octu, który jest w przybliżeniu w 0.5 % w normalnych warunkach.
Oznacza to, że największy odsetek roztworu kwasu octowego w wodzie, taki jak 5%octu gotowania, jest w postaci niezadowolonej (CH3Cooh); Podczas gdy niewielka porcja znajduje się jako baza koniugatu (wybierz3Gruchać-), w towarzystwie jonów H+, lub bardziej poprawnie, h jony3ALBO+.
Następnie, ponieważ ilość wodoru uwalnianego przez słaby kwas w roztworze wodnym jest niski, wytwarzane przez nich pH jest wyższe (podstawowe) niż wytwarzane przez silny kwas. Na przykład ocet ma pH 2.5, sok pomarańczowy pH 3.3. 4.2 i 2 sok z cytryny 2.
Te pH, chociaż są kwaśne, są wyższe niż pH, które wytwarzają roztwór silnego kwasu (HCl, H2południowy zachód4, itp.) że mogą osiągnąć wartość 1 lub mniej (wartości pH ujemnego).
Charakterystyka słabych kwasów
pH twoich rozwiązań
Słabe kwasy zwykle mają pH między 2.0 i mniej niż 7.0, więc odwracają kolor papieru Pannasol na czerwono. Te wartości pH są o wiele wyższe niż wartości pH wytwarzane przez silne kwasy, chociaż istnieją wyjątki.
Na przykład roztwór kwasu solnego 1 mm (silny kwas) ma pH 3.0, podczas gdy 1 mm roztwór kwasu fluorowego („słaby” kwas), ma pH 3.2, który jest blisko silnego kwasu.
Częściowa jonizacja
Słabe kwasy w roztworze są mało lub częściowo w wodzie, dysocjacyjną w sprzężonej podstawie jonów kwasu i wodoru. Następnie słaby kwas w roztworze wodnym jest w większości zdysocjowany, z niewielkim proporcją zdysocjowaną.
Może ci służyć: równoważenie równań chemicznychGdy ilość wodoru uwalnianego przez słaby kwas w wodzie jest niski, pH wytwarzane przez ten kwas jest wyższe niż wytwarzane przez silny kwas rozpuszczony w wodzie, ponieważ są one zwykle zjonizowane o 100 %.
Odwracalna jonizacja
Jonizacja słabego kwasu jest zwykle schematyzowana w następujący sposób:
Ma ⇌ a- + H3ALBO-
Gdzie jest słaby kwas, aby- jego skoniugowana baza i h3ALBO+ kation hydroniowy, który jest drogą w h+ Istnieje lub objawia się w wodzie. Stężenie (lub aktywność) H3ALBO+ Jest używany zamiast h+ Do określenia roztworu roztworu.
Stopień jonizacji
Niektóre kwasy są słabsze niż inne, co jest takie same, aby powiedzieć, że są mniej jonizowane. Dlatego stopień jonizacji pozwala nam spojrzeć na kwas kwasowy w określonych warunkach.
Aby wyrazić stopień jonizacji, wprowadzono kilka parametrów, takich jak jonizacja lub stała kwasowości (KA) i PKA: sposób wyrażania KA w prostej liczbie, która pomija użycie liczby wyrażonej w mocy ujemnych dziesięciu (10 ), ponieważ istnieje w Ka.
Stałe KA i PKA są stosowane głównie do słabych kwasów.
Ka = [a-] [H+] / [Ha]
Wsporniki obecne w wzorze reprezentują stężenia.
pKA = - log ka
Wartość PKA słabego kwasu wynosi zwykle od 2 do 12. Ale są wyjątki. Na przykład: i kwas odgiczny (hio3) ma PKA 0.77, który jest uważany za stosunkowo niewielką wartość, ale bez ujemnego, dla słabego kwasu w ścisłym sensie.
Stabilność bazowa koniugatu
Słabe kwasy mają silne wiązanie z atomem wodoru kwasu (hδ+-Xδ-), więc mają niski stopień dysocjacji wodoru. Powoduje to, że skoniugowana zasada słabego kwasu ma wielką awidność przez wodór, będąc silną skoniugowaną zasadą.
Może ci służyć: koloidOznacza to, że sprzężona zasada słabego kwasu jest bardzo niestabilna, ponieważ akceptuje h+ Wrócił bardzo łatwo. Bardziej niestabilna ta skoniugowana zasada, tym słabszy kwas będzie wątpliwy.
Niska przewodnictwo jonowe
Będąc mało jonizowanym, słabe kwasy to słabe przewody energii elektrycznej, w przeciwieństwie do silnych kwasów, które są dobrymi przewodnikami energii elektrycznej.
Obecność w naturze
Słabe kwasy są szeroko rozłożone w naturze, na przykład znajdują się w owocach cytrusowych (cytryna, grejpfrut, pomarańcz itp.).
Są one również obecne w wielu procesach występujących we wszystkich żywych istotach. Niektóre z tych biologicznych słabych kwasów to piruwiczne, mlecze, cytryny, fumaryczne, bursztynowe, glutamiczne itp., a nawet utleniona hemoglobina uwalnia wodogencje, więc zachowuje się jak słaby kwas.
Następnie można stwierdzić, że człowiek żyje w stałym kontakcie ze słabymi kwasami.
Jak obliczyć pH słabego kwasu?
PH słabego kwasu można obliczyć za pomocą stałej kwaśności (KA) lub za pomocą równania Henderson-Haselbalch. W pierwszym przykładzie zostanie użyte ka.
Ze stałą kwasowością
Obliczyć pH roztworu 0.5 m kwasu benzoesowego (c6H5Cooh), który ma stałą jonizacji (ka) = 1.8 x 10-5
C6H5Cooh ⇌ c6H5Gruchać- + H+ (1)
Jeśli ilość kwasu, który się dysocjuje, nazywa się x, wówczas 0.5 m-X będzie stężeniem słabego kwasu, który nie jest zdysocjowany w równowadze, ponieważ x stężenie koniugatowej podstawy stężenia kwasu benzoesowego i jonów wodorowych.
Równanie (1) można reprezentować w następujący sposób:
0.5 m-x ⇌ x +x
Słabe kwasy są jonizowane w bardzo niskim proporcji, więc stężenie kwasu benzoesowego w równowadze (0.5 m-X), można założyć jako 0.5 m, od x <<< 0.5. Sustituyendo en la expresión de Ka resolvemos para X:
Ka = [a-] [H+] / [Ha]
1.8 x 10-5 = (X) (x) / 0.5m
X2 = (1.8 x 10-5) (0.5m)
X = 3 x 10-3 M
Dlatego [h+] jest równe 3 x 10-3 M. Rozwiązujemy wtedy, obliczając pH:
Może ci służyć: Metoda MOHR: Podstawy, reakcje, procedura, zastosowaniaph = - log [h+]
= - log [3 x 10-3]
ph = 2.52
Zauważ, że pH jest stosunkowo kwaśne, ponieważ znajduje się poniżej 3 lub 4.
Z równaniem Henderson-Haselbalch
Równanie Henderson-Haselbalch służy do obliczenia pH roztworu buforowego:
ph = pKA + log [skoniugowana zasada] / [kwas]
Przykład:
Wodorotlenek sodu (NaOH) dodaje się do roztworu kwasu octowego, co wytwarza końcowe stężenie kwasu octowego (CH3Cooh) 1.11 x 10-2 mol/l i koniugatowe stężenie podstawy (wybierz3Gruchać-) z 0.44 x 10-2 Mol/L. Jeśli kwas octowy PKA wynosi 4.75 Oblicz pH roztworu.
ph = 4.75 +log [a-] / [Ha]
ph = 4.75 +dziennik (0.44 x 10-2 / 1.11 x 10-2)
= 4.75+ log 0.396
= 4.348
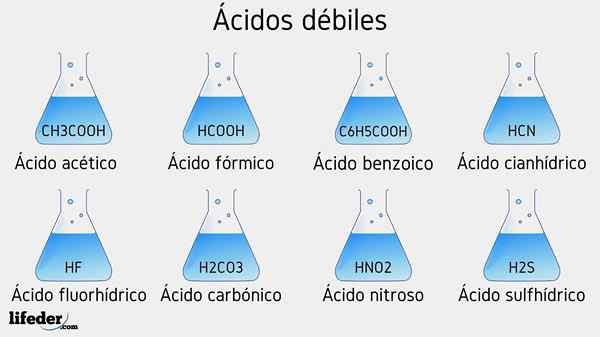
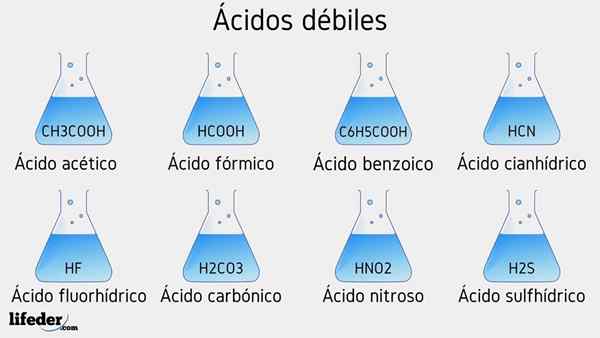
Słabe przykłady kwasu
Kilka słabych kwasów towarzyszy ich wartości PKA, zostanie wymienione poniżej:
- Ch3COOH (kwas octowy), PKA 4.75
- HCOOH (kwas mrówkowy), PKA 3.74
- C6H5COOH (kwas benzoinowy), PKA 5.59
- Ch2Clcooh (kwas chlorooctowy), PKA 2.85
- HCN (kwas cyjanhydowy), PKA 9.31
- Hf.17
- C2H5COOH (kwas propionowy), PKA 4.89
- Hno2 (Kwas azotu), PKA 3.35
- H2S (kwas siarczkowy), PKA1 6.0 i PKA2 12.92
- CCl3COOH (kwas trichlorooctowy), PKA 0.52
- H2WSPÓŁ3 (kwas węglowy), PKA1 6.37 i PKA2 10.22
- H3PO4 (kwas fosforowy), PKA1 2.12, PKA2 4.21 i PKA3 jedenaście.0
- C6H5południowy zachód3H (kwas benzefoniczny), PKA 0.70
- Hio3 (Kwas yodium), PKA 0.77
- Hclo2 (Chloro kwas), PKA 2.0
- Ch3Ch2(OH) COOH (kwas mlekowy), PKA 3.08
Słabe kwasy z zastosowaniem terapeutycznym
- Kwas salicylowy, PKA 3.00
- Kwas acetylosalicylowy, PKA 3.49
- Furosemide, PKA 3.90
- Ibuprofen, PKA 4.40
- Levodopa, PKA 2.30
- Fenobarbital, PKA 7.40
- Warfarina, PKA 5.0
- Teofilina, PKA 8.80
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Morris, J. G. (1974). Fizykochemia biologów. (2 wyd.). Odwróciłem się.
- Helmestine, Anne Marie, pH.D. (29 sierpnia 2020). Słaba definicja kwasu i przykład w chemii. Odzyskane z: Thoughtco.com
- Ophardt c., & McCarthy L. (15 sierpnia 2020). Siła kwasu i podstawy. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Clark Jim. (2013). Silny i słaby kwas. Odzyskane z: chemguide.współ.Wielka Brytania
- Uczenie się lumen. (S.F.). Chemia dla nieamałków: obliczenie pH słabych roztworów kwasowych i podstawowych. Odzyskane z: kursów.Lumenarning.com

