Struktura siarczanu manganu (MNSO4), właściwości, uzyskiwanie, zastosowania

- 2731
- 395
- Maksymilian Kępa
On siarczan manganu (ii) Jest to nieorganiczna substancja stała utworzona przez pierwiastki manganu (Mn), siarkę (s) i tlen (O). Jego formuła chemiczna jest MSO4. Jego bezwodny kształt (bez wody w strukturze) jest białą substancją stałą. Ma jednak kilka nawilżonych form i wszystkie z nich są różowymi ciałami stałymi.
Siarczan manganu w bardzo małych (niewielkich) ilościach jest stosowany jako mikroelement zarówno u zwierząt, jak i ludzi, ponieważ jest on wymagany do normalnego funkcjonowania organizmu.
 Siarczan manganu anhidro mnso4. YOSF0113 w angielskiej Wikipedii / domenie publicznej. Źródło: Wikimedia Commons.
Siarczan manganu anhidro mnso4. YOSF0113 w angielskiej Wikipedii / domenie publicznej. Źródło: Wikimedia Commons. Jest również dodawany z niektórymi nawozami w niedoborze gleb w uprawach rolniczych, które go potrzebują, takie jak rośliny winogronowe, takie jak rośliny winogronowe.
Ze względu na różowe zabarwienie jego uwodnionych odmian jest stosowany w pigmentach, które służą do malowania ceramiki, kolorowanki i innych materiałów. Służy również do uzyskania innych związków manganu.
Mons4 należy dokładnie manipulować. Jego wdychanie może powodować problemy z oddychaniem i powodować poważne niedogodności w układzie nerwowym, które obejmują objawy podobne do choroby Parkinsona.
Jego nadmiar może również spowodować uszkodzenie lądowania i zwierząt wodnych i roślin.
[TOC]
Struktura
Bezwodny siarczan manganu (bez wody w jego strukturze krystalicznej) powstaje przez jon manganu w utlenianiu +2, to znaczy mn2+ i anion siarczanowy42-.
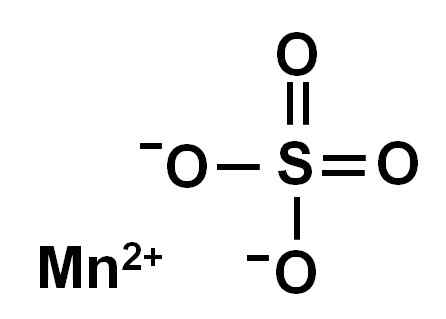 Struktura chemiczna siarczanu manganu4. Autor: Marilú Stea.
Struktura chemiczna siarczanu manganu4. Autor: Marilú Stea. Nomenklatura
- Siarczan manganu (ii)
- Manosulfate manganu
- Siarczan manganu anhidro mnso4
- Mangan mangan siarczanu mso4 •H2ALBO
- Tetrahydrate mangan siarczan mso4 •4h2ALBO
- Siarczan manganu pentahydrat4 •5h2ALBO
- Hepthydowany siarczan manganu4 •7h2ALBO
Nieruchomości
Stan fizyczny
Mons4 Bezhodny (bez wody w strukturze) to krystaliczna biała ciało stałe. Jednak uwodnione odmiany to różowe lub jasnoczerwone substancje stałe.
 Manganeso Siarczan Tetrahydrat Mnso4.4h2Lub jest różową stałą. Benjah-BMM27 / Public Domena. Źródło: Wikimedia Commons.
Manganeso Siarczan Tetrahydrat Mnso4.4h2Lub jest różową stałą. Benjah-BMM27 / Public Domena. Źródło: Wikimedia Commons. Waga molekularna
MSSO4 = 151 g/mol
MSSO4 •H2O = 169,02 g/mol
Temperatura topnienia
Bezwodne MSSO4 = 700 ° C
Monohydrat MSO4 •H2O = 400-450 ° C
Menso Tetrahydrat4 •4h2O = 30 ° C
Punkt wrzenia
Bezwodne MSSO4 = Rozkłada się na 850 ° C.
Może ci służyć: chlorek kobaltu (COCL2 (: struktura, nomenklatura, właściwościMenso Tetrahydrat4 •4h2O = 850 ° C
Gęstość
MSSO4 = 3,25 g/cm3
MSSO4 •H2O = 2,95 g/cm3
Rozpuszczalność
Bardzo rozpuszczalny w wodzie: 52 g/100 ml wody w 5 ° C. Alkohol rozpuszczalny. Nierozpuszczalne w eterze. Lekko rozpuszczalne w metanolu.
Ph
Rozwiązanie Monse4 •H2Lub 5% ma pH 3,7.
Właściwości chemiczne
Podczas rozpuszczania się w wodzie MNSO4 jest podzielony na jego jony MN2+ A więc42-.
Jon manganu (ii) mn2+ W roztworze kwasowym lub neutralnym jest powiązany z 6 cząsteczkami wody2Lub tworzenie jonu heksakuomangańskiego [mn (h (h (h2ALBO)6]2+, który jest różowy.
Jon heksaacuomanganu [mn (h (h (h2ALBO)6]2+ Jest dość odporny na utlenianie. W podstawowym pożywce (pH alkalicznym) jon ten staje się wodorotlenkiem manganu (II) MN (OH)2, który jest łatwo utleniony, tworząc związki manganu (III) i manganu (IV).
 Rozwiązania MSSO4 Kwasy są różowe przez obecność jonu heksakuomanganu [MN (H (H (H (H2ALBO)6]2+. Autor: Steve Cross. Źródło: Pixabay.Siarczan manganu ma kilka nawilżonych postaci, to znaczy z wodą h2Lub w krystalicznej strukturze.
Rozwiązania MSSO4 Kwasy są różowe przez obecność jonu heksakuomanganu [MN (H (H (H (H2ALBO)6]2+. Autor: Steve Cross. Źródło: Pixabay.Siarczan manganu ma kilka nawilżonych postaci, to znaczy z wodą h2Lub w krystalicznej strukturze.
Są to monohydrat mso4 •H2Lub, tetrahydrat mso4 •4h2Lub, mnse pentahydrate4 •5h2O i hepthydrate mso4 •7h2ALBO. Te nawilżone formy zawierają jon heksaakuomanganu [MN (H (H (H2ALBO)6]2+ W swoich kryształach i z tego powodu są różowymi ciałami stałymi.
Menso monohydratowe4 •H2Lub jest lekko wykina, co oznacza, że powoli traci część wody nawodnienia, gdy jest narażona na środowisko.
Uzyskanie
Mons4 można uzyskać przez leczenie tlenku manganu (II) MNO, MN Manghanious Wodorotlenek (OH)2 o Węglan manganu (II) MNCO3 Z kwasem siarkowym H2południowy zachód4.
MNCO3 + H2południowy zachód4 → MSSO4 + H2Lub + co2
Aplikacje
Jako uzupełnienie odżywcze
Siarczan manganu w niewielkich ilościach służy pewnym funkcjom ludzkiego ciała i zwierząt.
Dlatego jest to ważne jako użyteczny związek w odżywianiu i jest dostarczany jako suplement spożywczy. Jest stosowany w śladach (wyjątkowo małe ilości).
Wysokie kwoty mogą być bardzo toksyczne i szkodliwe.
W medycynie weterynaryjnej
Mons4 Podawane są ptaki corral (kurczaki, indyki, kaczki i faisany), aby zapobiec niedoborze lub braku elementu manganu u tych zwierząt.
Może ci podać: jodek potasu (KIO3)Brak manganu objawia się w nich na przykład, jak choroba zwana perozą, która jest deformacją kości młodych ptaków.
 Patitos może wymagać śladów Monste4 W swojej diecie, aby zapobiec perozie. Autorzy: s. Hermann i F. Richter. Źródło: Pixabay.
Patitos może wymagać śladów Monste4 W swojej diecie, aby zapobiec perozie. Autorzy: s. Hermann i F. Richter. Źródło: Pixabay. Dotyczy karmienia tych ptaków w bardzo małych ilościach lub śladach.
W rolnictwie
Siarczan manganu jest stosowany jako mikroelement w nawozach do winorośli (rośliny winogronowe) i plantacji tytoniu u niedoborów drabin w mangan.
Jednak niektóre badania wskazują, że nadmiar siarczanu manganu może hamować lub zmniejszyć tworzenie niektórych ważnych enzymów dla wzrostu roślin i ich wybuchów.
 W niektórych przypadkach ma to zastosowanie MNSO4 na ziemię, na której znajdują się rośliny winogronowe. Autor: Schwoaze. Źródło: Pixabay.
W niektórych przypadkach ma to zastosowanie MNSO4 na ziemię, na której znajdują się rośliny winogronowe. Autor: Schwoaze. Źródło: Pixabay. Na przykład stwierdzono, że jest toksyczny dla niektórych upraw, takich jak bawełna.
Mons4 Ma również zastosowanie w fungicydach i wraz z niektórymi związkami organicznymi jest częścią niektórych pestycydów.
W kilku aplikacjach
Mons4 Uwodnione jest używane przez jego zabarwienie do przygotowania pigmentów nieorganicznych, które są stosowane w czerwonych lakierach do ceramiki, w tkaninach i innych barwnikach materiałów.
Siarczan manganu jest stosowany w produkcji szkła, a mydła są również przygotowywane z nim.
 Niektóre płytki ceramiczne mogą zawierać pigmenty siarczanu manganu. Autor: Dwiilliams. Źródło: Pixabay.
Niektóre płytki ceramiczne mogą zawierać pigmenty siarczanu manganu. Autor: Dwiilliams. Źródło: Pixabay. Mons4 Jest to materiał wyjściowy do uzyskania elektrolitycznego metalu manganu (Mn), to znaczy poprzez zastosowanie energii elektrycznej do roztworów wodnych.
Pozwala także uzyskać dwutlenek manganu2 i węglan manganu3.
Mons4 Jest również stosowany do analizy chemicznej i w sformułowaniu roztworów stosowanych w eksperymentach genetycznych z mikroorganizmami.
Ryzyko
Siarczan manganu zawiera jon manganu (II) (Mn2+), które mogą być zarówno nieszkodliwe, jak i toksyczne w zależności od ilości, na które osoba, zwierzę lub roślina jest narażona.
Mangan jest niezbędny do normalnego funkcjonowania organizmu ludzi, zwierząt i niektórych roślin. Ale niestety mangan jest również neurotoksyczny, to znaczy wpływa na układ nerwowy i niektóre funkcje roślinne.
Może ci służyć: kto zaprojektował pierwszy nowoczesny termometr?Pozornie bezpieczne kwoty
Mons4 Podawane z żywnością w kształcie żywności (bardzo małe lub małe lub małe ilości) jest ogólnie bezpieczne przez administrację żywności i leków lub FDA (akronim dla angielskiego Administracja Jedzenia i Leków).
Niebezpieczne kwoty
Przedłużone lub powtarzające się narażenie na ten związek w znacznych ilościach może wyrządzić szkodę dla ludzi i zwierząt.
Powoduje podrażnienie w śluzowych oczach i błon śluzowych dróg oddechowych, anoreksji, bólu głowy, utraty równowagi, zapalenia płuc i infekcji oddechowych.
Przewlekłe wdychanie powoduje uszkodzenie układu nerwowego, generując manganizm, drżenie w typowych rękach i objawy choroby Parkinsona.
 Siarczan manganu wpływa na układ nerwowy. Autor: Sabine Zierer. Źródło: Pixabay.
Siarczan manganu wpływa na układ nerwowy. Autor: Sabine Zierer. Źródło: Pixabay. Dlatego należy unikać dyspersji pyłu mso4, Używaj sprzętu do oddychania i rękawiczek ochronnych.
Jest to toksyczne dla życia wodnego, a w tym generuje długoterminowe efekty. Musi być przechowywany w miejscach, w których nie ma dostępu do systemu drenażowego lub kanalizacyjnego. Bardzo ważne jest, aby nie pozwolić na odrzucenie go w środowisku.
Bibliografia
- LUB.S. National Library of Medicine. (2019). Mangan siarczanu. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Encyklopedia chemii przemysłowej Ullmanna. (1990). PIĄTA EDYCJA. Tom A22. VCH Verlagsgellschaft MBH.
- LUB.S. National Library of Medicine. (2019). Monohydrat siarczanu manganu. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Dunham, m.J. (2010). Przewodnik po genetyce YAST: genomika funkcjonalna, proteomika i inne analiza systemów. Średnie sformułowanie. W metodach enzymologii. Odzyskane z naukowym.com.
- Saric, m. i Lucchini, r. (2007). Mangan. Używasz. W Handbook on the Toxicology of Metals (wydanie trzecie). Odzyskane z naukowym.com.
- Vallero, zm. (2014). Neurologiczne skutki ognisków powietrznych. Mangan. W funduszach zanieczyszczenia powietrza (wydanie piąte). Odzyskane z naukowym.com.
- Wiwat. (1986). In vitro Kultura Vitis: Wpływ spektrum światła siarczanu manganu i jodku potasu na morfogenezę. Cell Cell, Tiss and Organ Cult 7: 121-134 (1986). Link odzyskał.Skoczek.com.

