Koncepcja sublimacji, proces i przykłady
- 2419
- 373
- Eugenia Czapla
sublimacja Jest to proces termodynamiczny, w którym zmiana stanu endotermicznego zachodzi bezpośrednio z stałego na gaz, bez wcześniejszego utworzenia cieczy. Znakomitym przykładem tego procesu jest suchy lód; Po wystawieniu na słońce lub zanurzony w cieczy, przechodzi bezpośrednio ze stanu stałego do gazowego.
Zachowanie substancji stałej w normalnych warunkach polega na ogrzewaniu się i rozpoczęciu pierwszej kropli, w której więcej stałych cząstek rozpuszcza się do całkowitego topnienia. Tymczasem w sublimacji mówi się o „bańce”, postępującej pary bez zwilżania powierzchni, która dotyka, ale natychmiast osadzona lub krystalizuje.
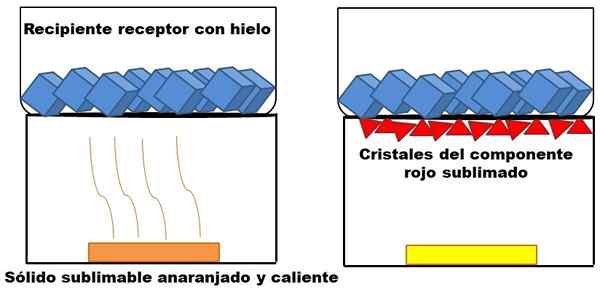
 Przykład sublimacji hipotetycznej pomarańczowej substancji stałej. Źródło: Gabriel Bolívar.
Przykład sublimacji hipotetycznej pomarańczowej substancji stałej. Źródło: Gabriel Bolívar. To, co zostało opisane w górnym akapicie, jest reprezentowane na lepszym obrazie. Załóżmy, że pomarańczowa stała mieszanka (po lewej), która zaczyna zwiększać swoją energię poprzez zwiększenie temperatury. Sublimalny czerwony komponent, a następnie osadzony na dole odbiorczego pojemnika, którego temperatura jest niższa z powodu kostek lodu w jego zawartości.
Czerwone trójkąty lub kryształy są osadzane dzięki zimnej powierzchni tego pojemnika (po prawej), która pochłania jego temperaturę; I nawet jeśli nie zostanie pokazane, rozmiar jego kostek lodu musi zmniejszyć się z powodu absorpcji ciepła. Pozostała substancja substancji stałego ma niewolniczy żółty komponent w warunkach procesowych.
[TOC]
Koncepcja sublimacji
Proces
Mówiono już, że sublimacja jest zmianą stanu endotermicznego, ponieważ w tym celu musi być absorpcja ciepła. Jeśli ciało stałe pochłania ciepło, jego energia wzrośnie, więc jego cząsteczki będą również wibrować przy większych częstotliwościach.
Kiedy wibracje te stają się bardzo silne, kończą się na interakcjach międzycząsteczkowych (nie wiązań kowalencyjnych); W związku z tym wcześniej czy później cząstki przejdą od siebie więcej odległości, dopóki nie będą one przepływać i swobodniej przemieszczają się przez obszary przestrzeni.
Może ci służyć: reguła przekątnaW niektórych ciałach stałych wibracje są tak silne, że niektóre cząstki są „wyzwalane” poza strukturą zamiast aglomerowania w klastrach mobilnych, które definiują kroplę. Cząstki te uciekają i integrują pierwszy „bąbelek”, który wolałby utworzyć pierwsze pary sublimowanej substancji stałej.
Wtedy nie mówi się nie o temperaturze topnienia, ale o sublimacji. Podczas gdy oba zależą od panującego ciśnienia na stałą, punkt sublimacji jest większy; Dlatego jego temperatura zmienia się znacznie wraz ze zmianami ciśnienia (jak ma to miejsce w przypadku temperatury wrzenia).
Od struktury stałej po zaburzenia gazowe
W sublimacji mówi się również, że istnieje wzrost entropii systemowej. Stany energetyczne cząstek wychodzą od ograniczenia ich ustalonymi pozycjami w strukturze stałej, do homogenizacji w ich kapryśnych i chaotycznych kierunkach w stanie gazowym, bardziej jednolite, gdzie ostatecznie nabywają średnią energię kinetyczną.
Schemat fazowy i potrójny punkt
Punkt sublimacji zależy od ciśnienia; Ponieważ w przeciwnym razie cząsteczki stałe wchłaniałyby ciepło, aby nie wystrzelić w przestrzeń poza stałą, ale tworząc krople. Nie byłoby sublimowane, ale stopiłoby się lub stopiłyby, jak najczęstsze.
Im większe ciśnienie zewnętrzne, tym mniej prawdopodobne będzie sublimacja, ponieważ stałe do stopu jest zobowiązane.
Ale które subplymnie są wysublimowane, a które nie? Odpowiedź leży w twoich diagramach faz P vs T, jak pokazano poniżej:
Może ci służyć: neon: historia, właściwości, struktura, ryzyko, użycia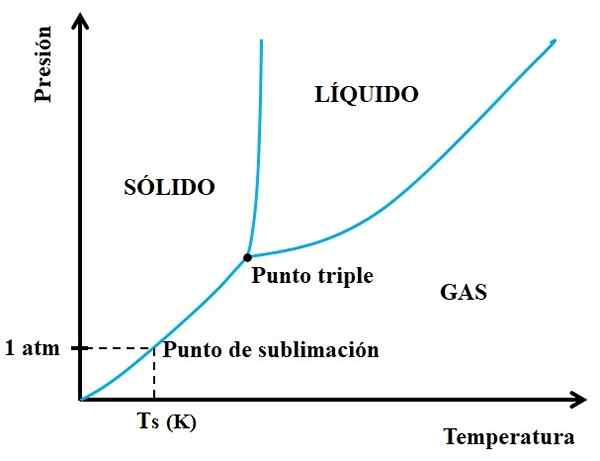 Schemat fazowy dla hipotetycznej substancji. Źródło: Gabriel Bolívar.
Schemat fazowy dla hipotetycznej substancji. Źródło: Gabriel Bolívar. Musisz najpierw spojrzeć na potrójny punkt i podróżować dolnym odcinkiem: ten, który oddziela stany stałe i gazowe. Należy zauważyć, że w stałym obszarze musi nastąpić spadek ciśnienia, aby wystąpić sublimacja (niekoniecznie 1 ciśnienie atmosferyczne). 1 atm, hipotetyczna substancja będzie podprogowa w temperaturze TS wyrażona w k.
Im dłuższy i dłuższy odcinek lub krzywa pod trzykrotnym punktem, tym większa zdolność stałego do podprogowego w różnych temperaturach; Ale jeśli jest znacznie poniżej 1 atm, będzie to potrzebne z dużymi lukami, aby osiągnąć sublimację, tak aby ciśnienia były zmniejszone (na przykład 0,0001 atm).
Warunki
Jeśli potrójny punkt jest tysiące razy niższy niż ciśnienie atmosferyczne, stała nigdy nie będzie wysublimowa ani nawet nie zastosuje ultra -life (nie wspominając o jego podatności na rozkład przez działanie ciepła).
Jeśli tak nie jest, sublimacje są wykonywane za pomocą umiarkowanie i poddawania ciał stałych do próżni, aby ich cząsteczki łatwiej uciekli, bez potrzeby wchłaniania tak dużej ilości ciepła.
Sublimacja staje się bardzo ważna, gdy są to szczególnie stałe o wysokim ciśnieniu pary; to znaczy ciśnienie w środku, odzwierciedlenie wydajności jej interakcji. Im większe jego ciśnienie pary, tym bardziej zapachowy jest, a także bardziej wysublimowany.
Przykłady
Solidne oczyszczenie
Obraz pomarańczowego stałego i jego wysublimowalnego czerwonawego komponentu jest przykładem tego, co reprezentuje sublimacja w odniesieniu do solidnego oczyszczania. Czerwone trójkąty mogą być ponownie objęte tyle razy.
Może ci służyć: szpatułka laboratoryjnaTa technika jest stosowana głównie z pachnącymi ciałami stałymi. Na przykład: kamfora, kofeina, benzoina i mentol.
Wśród innych stałych, które mogą wynosić sublimację: jod, lód (na wielkich wysokościach), teobromina (czekolada), sacharyna, morfina i inne leki, podstawy azotu i antraceen.
Synteza kryształów
Wracając do czerwonych trójkątów, sublimacja stanowi alternatywę dla konwencjonalnej krystalizacji; Kryształy nie będą już syntetyzowane z roztworu, ale za pomocą.
Powiedzmy, że jeśli mają czerwone kwadraty, wzrost kryształów utrzyma tę geometrię i nie powinien stać się trójkątny. Czerwone kwadraty będą stopniowo rosnąć, gdy zachodzi sublimacja. Jest to jednak kompleks operacyjny i molekularnie, w którym widać wiele zmiennych.
Przykładami zsyntetyzowanych kryształów poprzez sublimację to: węglik krzemu (SIC), grafit, arsen, selen, fosfor, gliniastei (ALN), siarczk kadmu (CDS), cynk seleniuro (Znse), jodek rtęci (HGI (HGI2), grafen, między innymi.
Należy zauważyć, że są to naprawdę dwa zjawiska skomponowane: postępująca sublimacja i osadzanie (lub sublimacja odwrotna); Para emigruje z stałego do chłodniejszych regionów lub powierzchni, aby ostatecznie osłabić w postaci kryształów.
Interesujące tematy
Przykłady sublimacji.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Wikipedia. (2019). Sublimacja (przejście fazowe). Źródło: w:.Wikipedia.org
- Jones, Andrew Zimmerman. (27 stycznia 2019). Sublimacja. Odzyskane z: Thoughtco.com
- Sheila Morrissey. (2019). Co to jest sublimacja w chemii? - Definicja, proces i egzaminy. Badanie. Odzyskane z: Study.com
- Elsevier b.V. (2019). Metoda sublimacji. Scientedirect. Pobrano z: Scientedirect.com
- « Charakterystyka podczaszek leśnych tropikalnych, flora, fauna
- Intefined Integral Choroberies, zastosowania, obliczenia (przykłady) »

