Historia krzemowa, właściwości, struktura, uzyskiwanie, zastosowania

- 3267
- 417
- Herbert Wróblewski
On krzem Jest to element niemetaliczny, a jednocześnie metaloid reprezentowany przez symbol chemiczny, jeśli. Jest to półprzewodnik, który jest istotną częścią komputerów, kalkulatorów, telefonów komórkowych, ogniw słonecznych, diod itp.; Jest to praktycznie główny element, który pozwolił na rozstrzygnięcie epoki cyfrowej.
Krzem zawsze był obecny w kwarcu i krzemianach, oba minerały komponują około 28% masy całej skorupy Ziemi. Jest to zatem drugi najliczniejszy element na powierzchni Ziemi, a ogrom pustyń i plaż oferuje perspektywę tego, jak obfite jest.
 Pustywy są obfitym naturalnym źródłem cząstek krzemionkowych lub granitów z innymi minerałami. Źródło: Pxhere.
Pustywy są obfitym naturalnym źródłem cząstek krzemionkowych lub granitów z innymi minerałami. Źródło: Pxhere. Krzem należy do grupy 14 tabeli okresowej, tak samo jak węgiel, znajdujący się poniżej tego. Dlatego ten element jest uważany za tetravalent metaloid; Ma cztery elektron w Walencji i teoretycznie możesz stracić je wszystkie, aby utworzyć kation, jeśli4+.
Nieruchomość, która dzieli się z węglem, jest jego zdolnością do połączenia; Oznacza to, że ich atomy są łączone kowalencyjnie w celu zdefiniowania łańcuchów molekularnych. Podobnie krzem może tworzyć własne „węglowodory”, zwane mułami.
Dominującymi związkami krzemu w naturze są słynne krzemiany. W swojej czystej postaci może wystąpić jako solidny monokrystaliczny, poliristalina lub amorficzny. Jest to stosunkowo obojętne stałe, więc nie stanowi znacznego ryzyka.
[TOC]
Historia
Kamień silikonowy
Krzem jest prawdopodobnie jednym z elementów, który miał największy wpływ na historię ludzkości.
Ten element jest bohaterem epoki kamienia, a także epoki cyfrowej. Ich początki sięgają, gdy cywilizacja pracowała z kwarcem i zrobiła własne szkło; A obecnie jest to główny element komputerów, laptopów i smartfonów.
Praktycznie krzem był kamieniem dwóch epok wyraźnie zdefiniowanych w naszej historii.
Izolacja
Kiedy krzemionka była tak obfita, nazwa zrodzona z Flint Rock, musiała zawierać niezwykle bogaty element w skórce Ziemi; To było udane podejrzenie Antoine'a Lavoisiera, który w 1787 r.
Jakiś czas później, w 1808 r. Humphry Davy podjął własne próby i przypisał swoje imię do elementu: „Krzem”, który przetłumaczył się jak „metal pedałowy”. Oznacza to, że krzem był wówczas uważany za metal z powodu braku charakterystyki.
Następnie w 1811 r. Francuscy chemicy Joseph L. Gay-Lussac i Louis Jacques Thénard udało się po raz pierwszy przygotować amorficzny krzem. W tym celu reagowali na tetrafluorek krzemu z metalicznym potasem. Jednak nie oczyszczali ani nie scharakteryzowali uzyskanego produktu, więc nie doszli do wniosku, że był to nowy element krzemowy.
To było nic innego, jak w 1823 r., Kiedy szwedzki chemik Jacob Berzelius uzyskał amorficzny krzem z wystarczającą czystością, aby rozpoznać go jako krzem; Nazwa podana w 1817 r. Berzelius przeprowadził reakcję między potasem a stopionym fluorokrzemianem potasu, aby wytworzyć ten krzem.
Krystaliczny krzem
Krystaliczny krzem został przygotowany po raz pierwszy w 1854 roku przez francuskiego chemika Henry'ego Deville'a. Aby to osiągnąć, Deville dokonał elektrolizy mieszaniny chlorków aluminiowych i sodu, uzyskując w ten sposób kryształy krzemu pokryte warstwą aluminiowego krzemowego, która wyeliminowała (najwyraźniej) mycie wody wodą wodą wodą wodą.
Fizyczne i chemiczne właściwości
Wygląd fizyczny
 Elementary krzem, który ma metalowy połysk, ale w rzeczywistości jest metaloidem. Źródło: Obrazy Hi-Res elementów chemicznych [CC o 3.0 (https: // creativeCommons.Org/licencje/według/3.0)]
Elementary krzem, który ma metalowy połysk, ale w rzeczywistości jest metaloidem. Źródło: Obrazy Hi-Res elementów chemicznych [CC o 3.0 (https: // creativeCommons.Org/licencje/według/3.0)] Krzem w swojej czystej lub elementarnej formie składa się z niebieskawo szarawego lub czarnego stałego (doskonałego obrazu), który, chociaż nie jest metalem, przedstawia jasne twarze tak, jakby tak naprawdę było.
Jest to twarda, ale krucha stała, która również wykazuje płaskonabłonkową powierzchnię, jeśli jest tworzona przez Polyristales. Z drugiej strony amorficzny krzem wygląda jak ciemnobrązowy sproszkowany stał. Dzięki temu łatwo jest zidentyfikować i rozróżnić jeden rodzaj krzem (krystaliczny lub polyristalan) od innego (amorficznego).
Masa cząsteczkowa
28.085 g/mol
Liczba atomowa (z)
14 (14Tak)
Temperatura topnienia
1414 ° C
Punkt wrzenia
3265 ºC
Gęstość
-W temperaturze pokojowej: 2,33 g/ml
-W punkcie topnienia: 2,57 g/ml
Należy zauważyć, że ciekł krzem jest gęstszy niż stały krzem; co oznacza, że ich kryształy będą unosić się na fazie ciekłej, jak w przypadku systemu wody lodowej. Wyjaśnienie wynika z faktu, że przestrzeń międzyatomowa między atomami, jeśli w jej szkle jest większa (mniej gęsta), niż odpowiadająca w cieczy (gęstsza).
Fusion Heat
50,21 kJ/mol
Ciepło parowe
383 kJ/mol
Molowa pojemność cieplna
19 789 J/(mol · k)
Elektronialiczność
1.90 na skali Pauling
Energie jonizacyjne
-Po pierwsze: 786,5 kJ/mol
-Drugi: 1577,1 kJ/mol
-Po trzecie: 3231,6 kJ/mol
Radio atomowe
111 PM (mierzone w odpowiednich kryształach diamentów)
Przewodność cieplna
149 W/(M · K)
Rezystancja
2.3 · 103 Ω · m do 20 ° C
Twardość mohs
6.5
Powiązanie
Atomy silikonowe mają zdolność tworzenia prostych linków Si-Si, które ostatecznie definiują łańcuch (si-si-si ...).
Ta właściwość przejawia się również przez węgiel i siarkę; Jednak hybrydyzacje SP3 krzem jest bardziej niedobór w porównaniu z pozostałymi dwoma elementami, a ponadto ich orbitale 3P są bardziej rozproszone, więc nakładanie się orbitali sp sp3 W rezultacie jest słabszy.
Może ci służyć: reakcje egzotermiczne i endotermiczneŚrednie energie wiązań kowalencyjnych Si-Si i C-C wynoszą odpowiednio 226 kJ/mol i 356 kJ/mol. Dlatego łącza Si-I są słabsze. Z tego powodu krzem nie jest kamieniem węgielnym życia (ani siarki). W rzeczywistości najdłuższy łańcuch lub szkielet, który może tworzyć krzem, to zwykle cztery członkowie (jeśli4).
Liczby utleniania
Krzem może mieć dowolną z poniższych liczb utleniania, zakładając w każdym z nich istnienie jonów z odpowiednimi obciążeniami: -4 (tak4-), -3 (tak3-), -2 (tak2-), -1 (tak-), +1 (tak+), +2 (tak2+), +3 (tak3+) i +4 (tak4+). Spośród nich najważniejsze są -4 i +4.
Na przykład -4 zakłada się w krzemach (mg2Tak lub Mg22+Tak4-); podczas gdy +4 odpowiada krzemionce (Sio2 albo jeśli4+ALBO22-).
Reaktywność
Krzem jest całkowicie nierozpuszczalny w wodzie, a także mocne kwasy lub zasady. Jednak rozpuszcza się w skoncentrowanej mieszaninie kwasów azotowych i fluorhorycznych (HNO3-HF). Podobnie rozpuszcza się w gorącym roztworze alkalicznym, następująca reakcja chemiczna:
Tak (s) + 2naoh (ac) + h2Lub (l) => na2Sio3(AC) + 2H2(G)
Metaselian sodu, na2Sio3, Powstaje również, gdy krzem rozpuszcza się w stopionym węglanie sodu:
Tak (s) + na2WSPÓŁ3(L) => na2Sio3(L) + C (S)
W temperaturze pokojowej w ogóle nie reaguje z tlenem, nawet w 900 ° C, kiedy zaczyna się tworzyć ochronna warstwa szklista SIIO2; A następnie, w 1400 ° C, krzem reaguje z azotem powietrza, tworząc mieszaninę nithur3N4.
Krzem reaguje również w wysokich temperaturach z metaliami, tworząc metalowe krzemowe:
2mg (s) + tak (s) => mg2Tak (s)
2CU (s) + tak (s) => cu2Tak (s)
W temperaturze pokojowej reaguje wybuchowe i bezpośrednio z halogenami (nie ma warstwy SIO2 To chroni przed tym). Na przykład masz reakcję tworzenia SIF4:
Tak (s) + 2f2(g) => SIF4(G)
I chociaż krzem jest nierozpuszczalny w wodzie, Red Alive reaguje z prądem pary:
Tak (s) + h2Lub (g) => si2(s) + 2h2(G)
Struktura elektroniczna i konfiguracja
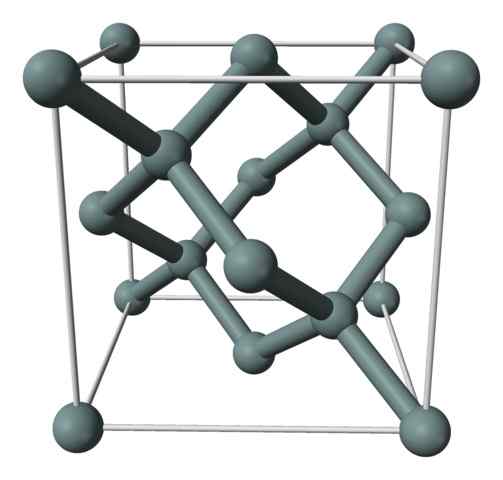 Struktura krystaliczna lub jednolita komórka krzemu reprezentowana z modelem sfer i prętów. Źródło: Benjah-BMM27 [domena publiczna]
Struktura krystaliczna lub jednolita komórka krzemu reprezentowana z modelem sfer i prętów. Źródło: Benjah-BMM27 [domena publiczna] Górny obraz pokazuje strukturę sześcienną wyśrodkowaną na twarzach (FCC), taka sama jak w diamencie, dla kryształu krzemu. Szare kule odpowiadają atomom, jeśli, jak się doceniono, są one kowalencyjnie ze sobą powiązane; Ponadto mają środowiska czworościenne, które rozmnażają się wzdłuż szkła.
Kryształ krzemowy to FCC, ponieważ obserwuje się atom, jeśli znajduje się na każdej z twarzy kostki (6 × 1/2). Istnieje również osiem atomów, jeśli w wierzchołkach kostki (8 × 1/8) i cztery znajdujące się w nim (te, które pokazują wokół nich dobrze zdefiniowany tetrahedron, 4 × 1).
Powiedział powyżej, każda komórka jednostkowa ma ogółem osiem atomów krzemu (3 + 1 + 4, liczby wskazane w powyższym akapicie); Charakterystyka, która pomaga wyjaśnić jego wysoką twardość i sztywność, ponieważ czysty krzem jest kowalencyjnym kryształem i diamentem.
Kowalencyjny charakter
Ten kowalencyjny charakter wynika z faktu, że podobnie jak węgiel, krzem ma cztery elektrony walencyjne zgodnie z konfiguracją elektroniczną:
[Ne] 3s2 3p2
Aby połączyć, czyste orbitale 3s i 2p są bezużyteczne. Dlatego atom tworzy cztery hybrydowe orbitale SP3, Z którymi można utworzyć cztery kowalencyjne wiązania Si-Si i w ten sposób ukończyć oktet Walencji dla dwóch atomów krzemowych.
Kryształ krzemowy jest następnie wizualizowany jako kowalencyjna i trójwymiarowa sieć złożona z połączonych tetrahedr.
Jednak ta sieć nie jest doskonała, ponieważ przedstawia wady i granice ziarna, które oddzielają i definiują kryształ od innej; A gdy takie kryształy są bardzo małe i liczne, mówi się o poliyrystalinie stałej, zidentyfikowanej przez jego heterogeniczną jasność (podobną do oszustów mozaiki lub srebra powierzchniowego).
Przewodność elektryczna
SI-IF łączy z ich dobrze zlokalizowanymi elektronami, zasadniczo nie zgadzają się z tym, czego oczekuje się od metalu: morzem elektronów „zwilżających” ich atomy; Przynajmniej tak jest w temperaturze pokojowej.
Jednak gdy temperatura rośnie, krzem zaczyna napędzać energię elektryczną, a zatem zachowuje się jak metal; Oznacza to, że jest to półprzewodnikowy element metaloidowy.
Amorficzny krzem
Tetrahederowie krzemowe nie zawsze przyjmują wzór strukturalny, ale mogą być ułożone w nieuporządkowany sposób; I nawet z atomami krzemu, których hybrydyzacje wydają się3 Ale sp2, co przyczynia się do dalszego zwiększenia stopnia zaburzeń. Dlatego mówi się o amorficznym i niekrystalicznym krzemu.
W amorficznym krzemu występują wakaty elektroniczne, w których niektóre z ich atomów mają orbital z elektronem. Dzięki temu jego stał może sam wodór, co powoduje tworzenie wodogennego amorficznego krzemu; Oznacza to, że ma połączenia SI-H, z którymi tetrahedry są uzupełniane w pozycjach nieuporządkowanych i arbitralnych.
Może ci służyć: linki międzyatomiczneW tej sekcji stwierdzono następnie stwierdzenie, że krzem można przedstawić w trzech rodzajach ciał stałych (nie wspominając o jego stopniu czystości): krystaliczny, polyristalina i amorficzny.
Każdy z nich ma swoją własną metodę lub proces produkcji, a także zastosowania i dylemat przy podejmowaniu decyzji, które z tych trzech użyć, znając swoje zalety i wady.
Gdzie to jest i uzyskaj
 Kryształy kwarcowe (krzemionka) są jednym z głównych i najbardziej niezwykłych minerałów, w których znajduje się krzem. Źródło: James St. John (https: // www.Flickr.com/Photos/Jsjgeology/22437758830)
Kryształy kwarcowe (krzemionka) są jednym z głównych i najbardziej niezwykłych minerałów, w których znajduje się krzem. Źródło: James St. John (https: // www.Flickr.com/Photos/Jsjgeology/22437758830) Silicon to siódmy najliczniejszy element wszechświata, a drugi w skórce Ziemi, również wzbogacając płaszcz Ziemi o rozległe rodzinę minerałów. Ten element jest niezwykle dobrze powiązany z tlenem, tworząc szeroki zakres tlenków; Wśród nich krzemionka, więc2, i krzemiany (różnorodny skład chemiczny).
Krzemionkę można zobaczyć nagim okiem na pustyniach i plażach, ponieważ piasek składa się głównie z Sio2. Z kolei tlenek ten może objawiać się w kilku polimorfach, będąc najczęstszym: kwarc, ametyst, agat, Christobalite, Trypolis, Coesite, Stishovita i Thundimita. Ponadto można go znaleźć w amorficznych ciałach stałych, takich jak opale i ziemie diatomea.
Tymczasem krzemiany są jeszcze bogatsze strukturalnie i chemicznie. Wśród niektórych krzemianów minerały można wymienić: azbest (biały, kawa i niebieskawe), skalenia, gliny, błony, oliwki, aluminokręciany, zeolity, amfibra i piroksen.
Praktycznie wszystkie skały składają się z krzemu i tlenu, z ich stabilnymi wiązaniami Si-O oraz ich krzemianami i krzemianami zmieszanymi z tlenkami metali i gatunkami nieorganicznymi.
-Redukcja krzemionki
Problemem reprezentującym uzyskanie krzemu jest złamanie tego łącza Si-O, dla którego potrzebne są specjalne piekarniki i dobra strategia redukcji. Surowcem dla tego procesu jest krzemionka w kształcie kwarcu, która porusza się wcześniej, aż będzie to drobny proszek.
Z tej mielonej krzemionki można ją przygotować albo przez amorficzny krzem lub polyristalinę.
Amorficzny krzem
Na małą skalę, wykonane w laboratorium i przy odpowiednich pomiarach, krzemionka miesza się z pyłem magnezu w tyglu i spalany przy braku powietrza. Następna następna reakcja następuje:
Sio2(s) + mg (s) => 2MGO (s) + tak (s)
Magnez i tlenek eliminuje się rozcieńczonym roztworem kwasu solnego. Następnie pozostałe ciało stałe traktuje się kwasem fluorhorowym, tak aby kończyła reakcję SIO2 w nadmiarze; W przeciwnym razie nadmiar magnezu sprzyja tworzeniu się odpowiedniego siliciuro, mg2Tak, niepożądany związek dla procesu.
Sio2 Przekształca się w lotny gaz SIF4, który jest odzyskany w przypadku innej syntezy chemicznej. Wreszcie amorficzne ciasto krzemowe jest suszone pod prądem wodoru gazowego.
Inną podobną metodą uzyskania amorficznego krzemu jest użycie tego samego SF4 wcześniej wyprodukowane lub sicl4 (wcześniej nabyty). Opary tych krzemowych halogenomonów są przepuszczane nad ciekłym sodem w obojętnej atmosferze, dzięki czemu zmniejszenie gazu można podać bez obecności tlenu:
Sicl4(g) + 4na (l) => Tak (s) + 4NACL (l)
Co ciekawe, w przypadku amorficznego krzemu produkowane są panele słoneczne o wysokiej energii.
Krystaliczny krzem
Zaczynając od nowa od sproszkowanej krzemionki lub kwarcu, są one zabierane do elektrycznego piekarnika łukowego, gdzie reaguje z koksu. W ten sposób środek redukujący nie jest już metalem, ale materiałem węglowym o wysokiej czystości:
Sio2(s) + 2c (s) => Tak (s) + 2co (g)
W reakcji wytwarzany jest również węglik krzemowy, SIC, który jest zneutralizowany z nadmiarem SIO2 (Ponownie kwarc jest nadmiernie):
2Sic (s) + SIO2(s) => 3SI (s) + 2co (g)
Inną metodą przygotowania krystalicznego krzemu jest stosowanie aluminium jako środka redukującego:
3Sio2(s) + 4al (l) => 3SI (s) + 2al2ALBO3(S)
I zaczynając od potasu szesnastroworuarykatu, k2[SIF6], reaguje go również z metalowym aluminium lub potasem, aby powodować ten sam produkt:
K2[SIF6] (L) + 4al (l) => 3SI (s) + 6kf (l) + 4Alf3(G)
Natychmiast krzem rozpuszcza się w stopionym aluminium, a gdy układ się chłodzi, pierwszy krystalizuje i oddziela się od drugiego; to znaczy powstają kryształy krzemu, które wyglądają na szare kolory.
Krzem poliristalinowy
W przeciwieństwie do innej syntezy lub produkcji, aby uzyskać silikon poliristalinowy, zaczyna się od fazy gazowej silano, SIH4. Gaz ten ulega pirolizy powyżej 500 ° C, w taki sposób, że nastąpiło rozkład termiczny, a zatem, jego początkowe opary, kończą się na osadzaniu krzemowych polyristali na powierzchni półprzewodników.
Poniższe równanie chemiczne jest przykładem reakcji, która ma miejsce:
tak h4(g) => Tak (s) + h2(G)
Oczywiście w komorze nie powinno być tlenu, ponieważ reagowałby z SIH4:
tak h4(g) + 2nd2(g) => sio2(s) + 2h2O (g)
A spontaniczność reakcji spalania jest taka, która występuje szybko w temperaturze pokojowej na twarzy.
Kolejna syntetyczna droga do wytworzenia tego rodzaju krzemowej części krystalicznego krzemu jako surowca. Sprawiają, że reaguje z chlorkiem wodoru w temperaturze około 300 ° C, tak aby powstało trichlorosilano:
Może ci służyć: żelazo (element): charakterystyka, struktura chemiczna, używaTak (s) + 3HCl (g) => sicl3H (g) + h2(G)
I sicl3H reaguje na 1100 °
4sicl3H (g) => tak (s) + 3Sicl4(g) + 2h2(G)
Wystarczy zobaczyć równania, aby dać wyobrażenie o pracy i rygorystycznych parametrach produkcyjnych, które należy wziąć pod uwagę.
Izotopy
Krzem jest naturalnie i głównie jako izotop 28Tak, z obfitością 92,23%.
Oprócz tego istnieją dwa inne izotopy, które są stabilne i dlatego nie cierpią rozpadu radioaktywnego: 29Tak, z obfitością 4,67%; I 30Tak, z obfitością 3,10%. Bycie tak obfite 28Tak, nic dziwnego, że masa atomowa krzemu wynosi 28 084 u.
Krzem może być również w kilku radioizotopach, wśród których 31Tak (T1/2= 2,62 godziny) i 32Tak (T1/2= 153 lata). Inni (22Tak - 44Jeśli oni mają T1/2 Bardzo krótkie lub krótkie (mniej niż setne sekundy).
Ryzyko
Czysty krzem jest substancją stosunkowo obojętną, więc zwykle nie gromadzi się w żadnym narządie lub tkance, o ile narażenie na nią jest niskie. W postaci pyłu może powodować podrażnienia oczu, powodując łzy lub zaczerwienienie, a jednocześnie dotknięcie go może powodować dyskomfort skóry, swędzenie i obieranie.
Gdy ekspozycja jest bardzo wysoka, krzem może zranić płuca; Ale bez kolejnych efektów, chyba że kwota jest wystarczająca, aby spowodować uduszenie. Jednak nie dzieje się tak w przypadku kwarcu, co jest związane z rakiem płuc i chorobami, takimi jak zapalenie oskrzeli i rozedma płuc.
Podobnie, czysty krzem ma bardzo rzadki charakter, a jego związki, tak obfite w skórce Ziemi, nie reprezentują żadnego ryzyka dla środowiska.
Teraz, w odniesieniu do narządów, mogą one być toksyczne; Ale posiadanie wielu z nich zależy od tego, który jest uważany za inne czynniki (reaktywność, pH, mechanizm działania itp.).
Aplikacje
Przemysł budowlany
Minerały krzemu integrują „kamień”, z którym budowane są budynki, domy lub zabytki. Na przykład cegiery, beton, sztukateria i cegły oporne na stałe, składają się z mieszanin stałych opartych na krzemianach. Na podstawie tego podejścia można wydawać użyteczność, którą ten element ma w miastach i architekturze.
Szkło i ceramika
Z krzemionki można wytwarzać kryształy stosowane na urządzeniach optycznych, niezależnie od tego, czy jako izolatory, komórki do próbek spektrofotometrów, kryształów piezoelektrycznych czy zwykłych szklanek.
Ponadto, gdy materiał jest przygotowywany z wieloma dodatkami, w końcu przekształca się w amorficzne stałe, znane jako szkło; a góry piasku są zwykle źródłem krzemionki lub kwarcu niezbędnego do jego produkcji. Z drugiej strony, z krzemianami ceramicznymi i porcelanowymi materiałami.
Połączenie pomysłów, krzem jest również obecny w rzemiosłach i ornamentacjach.
Stopy
Atomy silikonowe mogą spójne i być mieszane z metalową matrycą, więc są one dodatkiem do licznych stopów lub metali; Na przykład stal, do produkcji jąder magnetycznych; brązowe, do produkcji kabli telefonicznych; i aluminium, w produkcji stopu aluminium-Sailicio dla lekkich części samochodowych.
Dlatego nie tylko można go znaleźć w „kamieniu” budynków, ale także w metalach ich kolumn.
Duszniki
 Galaczno -krzemionkowe kulki, stosowane jako osuszki. Źródło: Desiccants [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Galaczno -krzemionkowe kulki, stosowane jako osuszki. Źródło: Desiccants [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Krzemionka, w postaci żelu lub amorficznego, pozwala na wytwarzanie ciał stałych, które działają jako wysuszniki podczas łapania cząsteczek wody, które wchodzą do pojemnika i utrzymują ich wewnętrzne suche.
Przemysł elektroniczny
 Do produkcji paneli słonecznych stosuje się polirista i amorficzny. Źródło: Pxhere.
Do produkcji paneli słonecznych stosuje się polirista i amorficzny. Źródło: Pxhere. Krzemowe warstwy o różnych grubościach i kolorach są częścią układów komputerowych, a także z ich stałą (krystaliczną lub amorficzną), zaprojektowano obwody zintegrowane i ogniwa słoneczne.
Będąc półprzewodnikiem, atomy są włączone z mniej (AL, B, GA) lub więcej elektronów (P, As, Sb), aby przekształcić go w półprzewodniki typu P albo N, odpowiednio. Z dwoma związkami krzemowymi, jeden N i inni P, Produkowane są diody emiterów światła.
Silikonowe polimery
Słynny klej silikonowy składa się z organicznego polimeru wspieranego przez stabilność łańcuchów łączy Si-O-SI ... jeśli te łańcuchy są bardzo długie, krótkie lub usieciowane, właściwości zmiany polimeru silikonowego, a także ich końcowe aplikacje.
Wśród jego zastosowań można wymienić poniżej:
-Kleje lub kleje, nie tylko do dołączenia do papierów, ale bloków konstrukcyjnych, gumowych, szklanych paneli, skał itp.
-Smary w systemach hamowania hydraulicznego
-Wzmacnia obrazy i poprawia jasność i intensywność ich kolorów, jednocześnie, co pozwala oprzeć się zmianom temperatury bez pękania lub karmat
-Są one używane jako spraye odstraszające wodę, które pozostają suche niektóre powierzchnie lub przedmioty
-Dają osobiste produkty higieny (makaron dentystyczny, szampon, żele, kremy z brzytwy itp.) Poczucie bycia jedwabistą
-Jego powłoki chronią elektroniczne elementy delikatnych urządzeń przed ciepłem i wilgocią, takie jak mikroprocesory
-Z silikonowymi polimerami, kilka gumowych kul, które odbijają się ledwo upuszczane na podłogę.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2019). Krzem. Źródło: w:.Wikipedia.org
- Mikrochemikalia. (S.F.). Krystalografia krzemu. Odzyskane z: mikrochemikaliów.com
- Lentech b.V. (2019). Tabela okresu: silikon. Odzyskane z: lentech.com
- Marques Miguel. (S.F.). Krzem następuje. Odzyskane z: Nautilus.Fis.UC.Pt
- Bardziej hemant. (5 listopada 2017). Krzem. Odzyskane z: Hemantmore.org.W
- Pilgaard Michael. (22 sierpnia 2018 r.). Krzem: występowanie, izolacja i synteza. Odzyskane z: Pilgaardelelegs.com
- Dr. Doug Stewart. (2019). Fakty elementów silikonowych. Chemicool. Odzyskane z: Chemicool.com
- Christiana Honsberg i Stuart Bowden. (2019). Zbiór zasobów dla edukatora fotowoltaicznego. Pwealacja. Pobrano z: Peveducation.org
- American Chemistry Council, Inc. (2019). Silikony w życiu codziennym. Odzyskane z: sehsc.Amerykalica.com
- « Strategie dystrybucji Rodzaje i przykłady
- Rodzaje strategii produktu, jak to się robi i przykład »

