Haloidowe nieruchomości sprzedaży, nomenklatura, jak są one tworzone, przykłady

- 656
- 147
- Bertrand Zawadzki
sole haloid Są to związki binarne utworzone przez metal i nie -metal, bez żadnego innego elementu. Sole te powstają w wyniku reakcji neutralizacji między kwasem hydrazy z zasadą. Na przykład: reakcja między kwasem solowym (HCL) z wodorotlenkiem sodu (NaOH) z utworzeniem chlorku sodu (NaCl).
Sole haloidalne są również tworzone przez reakcję hydracy z metalem. Na przykład: reakcja magnezu z kwasem solnym z wytworzeniem chlorku magnezu (MGCL2). Jak widać, chlorki są najbardziej reprezentatywnymi solami haloidowymi. Jednak nie są jedynymi.
 Halita, chlorek sodu w stanie naturalnym, jest głównym przykładem soli haloidowej. Źródło: http: // gl.Wikipedia.org/w/indeks.Php?Tytuł = użytkownik: Shinichi / Public Domena
Halita, chlorek sodu w stanie naturalnym, jest głównym przykładem soli haloidowej. Źródło: http: // gl.Wikipedia.org/w/indeks.Php?Tytuł = użytkownik: Shinichi / Public Domena Sole haloidowe, zgodnie z niektórymi definicjami, rozumieją związki, które zawierają w ich strukturze halogenowej; To znaczy: fluor, chlor, brom i jod, więc są uważane za synonim halogenków lub halogenomów.
Podobnie, w soli haloidowych są uwzględnione przez niektórych autorów związki utworzone przez połączenie metalu z elementem, który wykorzystuje jego ujemną wartościowość, w tym: węgliki, azotki, fosfurę, sulfidy, seleniuros, Arseniuros, itp. Liczą się również jako sole haloidowe, ilekroć składają się one z dwóch elementów.
[TOC]
Haloid właściwości sprzedaży
Sole haloidowe to grupa związków, których właściwości są trudne do ustalenia.
Silne linki jonowe
Ogólnie składają się one z ciał stałych z silnymi wiązaniami jonowymi między jonami dwóch elementów: m+X-, gdzie m+ odpowiada metalicznym kationowi i x- anion pochodzący z nie -metal.
Wysokie temperatury, gotowanie i sublimacja
Zwykle mają bardzo wysokie punkty fuzji, wrzenia i sublimacji, ze względu na siłę jej struktury krystalicznej.
Może ci służyć: Dapi (4 ', 6-diamidino-2-fenyloindol): Charakterystyka, fundament, użyciePrzewodnictwo elektryczne
W stanie stałym są złymi przewodami energii elektrycznej, ale w wodnym roztworze podczas jonizacji lub kiedy się łączą, dobrzy kierowcy stają się.
Wygląd
Są krystaliczne ciśnie stałe, które po fragmentach sproszkowanych mogą stać się białym zabarwieniem. Jednak wiele soli haloidowych może mieć inne zabarwienie. Na przykład chlorek niklu jest zielony, podczas gdy chlorek żelazowy ma oscylacyjne zabarwienie między zielonymi i czerwonymi.
Rozpuszczalność
Większość soli Halluros jest rozpuszczalna w wodzie, z wyjątkiem srebra, ołowiu (ii) i halogenków rtęciowych (i).
Zapach
Ponieważ nie są to lotne związki, sole haloidowe nie przedstawiają silnych zapachów. Ponadto, ze względu na ich skład, mogą być kwaśne, słone, gorzkie lub słodkie smaki.
Nomenklatura
Sole haloidowe są nazwane przez umieszczenie nazwy anionu z sufiksem żubr, a następnie nazwa metalu bezpośrednio, poprzedzona koniunkcją z. W przypadku, gdy metal ma więcej niż jedną walencję, metal jest umieszczany z sufiksem niedźwiedź lub ICO, W zależności od jego Walencji.
Nazwę metalu można również umieścić bez sufiksu i z liczbą utleniania w nawiasach.
Na przykład: chlorek żelaza (III) lub chlorek żelazowy, FECL3.
Jak powstają sole haloidowe?
Sole haloidowe powstają głównie przez trzy reakcje: neutraliza.
Reakcja neutralizacji
Jest to reakcja kwasu z zasadą, wytwarzającą sól i cząsteczki wody. Na przykład:
HCl +NaOH → NaCl +H2ALBO
Ten przykład został wspomniany księciu.
Reakcja kwasu z metalem
Silny kwas może reagować z metalem, pochodzącym z soli i uwalniania wodoru (H (H2). Na przykład: kwas chlorowodorowy reaguje z cynkiem (Zn) z wytworzeniem chlorku cynku (ZNCL2):
Może ci służyć: chemia analitycznaZn +HCl → ZnCl2 + H2
Połączenie metalu z metalem lub nie -metalowym
Te sole haloidowe wynikają z kombinacji metalu z metalem lub nie -metalowym z halogenów. Na przykład: aluminiowy fosfuro łączy fosfor z walencją -3, z aluminium z walencją +3. Teraz ta „kombinacja” jest spowodowana specyficznymi reakcjami produkcyjnymi dla każdej soli.
Używa/aplikacje
Metalowe halogenomory
Metalowe halogenomory są stosowane w lampach o wysokiej intensywności, takich jak nowoczesne lampy. Są również używane w szklarniach lub klimatach deszczowych, aby uzupełnić naturalne światło. Srebrne halogenki są używane w filmach i papierach fotograficznych.
Chlorek wapnia
 Wygląd chlorku wapnia
Wygląd chlorku wapnia Chlorek wapnia jest stosowany jako źródło wapnia w oczyszczaniu ścieków. Jest również stosowany jako źródło wapnia poprzez elektrolizę. Jest stosowany w leczeniu arytmii sercowych i w przypadkach ciężkiej hipokalcemii.
Chlorek żelaza
Chlorek żelazowy jest stosowany w oczyszczaniu ścieków i oczyszczaniu wody. Służy również do rejestrowania lub wyboru miedzi i interweniowania jako katalizator w procesie syntezy chlorku winylu.
Chlorek i bromek potasowy
Chlorek potasu jest stosowany jako nawóz i w leczeniu hipokaliemii lub hipokalemii. Z drugiej strony bromek potasowy był stosowany jako antykonwulsyjny i jest obecnie stosowany w branży farmaceutycznej i jako opatrunku.
Chlorek i siarczk sodu
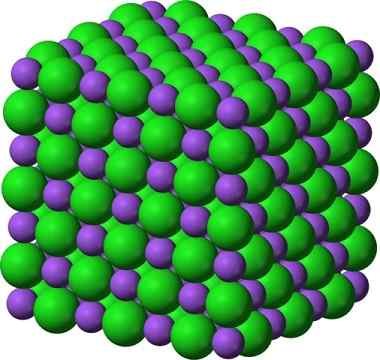
 Krystaliczna struktura chlorku sodu, NaCl, typowego związku jonowego. __ fioletowe kule reprezentują kationy sodu, Na +i __ zielone kule reprezentują chlorku ANCIES, CL–.
Krystaliczna struktura chlorku sodu, NaCl, typowego związku jonowego. __ fioletowe kule reprezentują kationy sodu, Na +i __ zielone kule reprezentują chlorku ANCIES, CL–. Chlorek sodu jest stosowany jako smak pokarmowy, w ochronie mięsa, jako antyseptyczny, w ciężkiej hiponatremii itp. Siarczek sodu jest stosowany w reaktorach jądrowych w ciężkiej produkcji wody, w eliminacji włosów skórki oraz w produkcji gumy, barwników i obrazów.
Może ci służyć: tlenek glinu: struktura, właściwości, zastosowania, nomenklaturaFosfuros i nituros
Aluminiowy fosfuro jest stosowany jako półprzewodnik szerokiego pasma i jako owadobójca. Tymczas.
Przykłady soli haloidowych
Oprócz przykładów wymienionych w poprzedniej sekcji, inne sole haloidowe z odpowiednimi formułami i nazwami:
-NaCl: chlorek sodu
-KCl: Chlorek potasowy
-Cacl2: Chlorek wapnia
-MGCL2: Chlorek magnezu
-CSCL: chlorek cezu
-Bacl2: Chlorek barowy
-Fecl2: Chlorek żelaza
-Fecl3: Chlorek żelaza
-Nicl2: Chlorur niklu
-CUCL: Chlorek miedzi
-Cucl2: Chlorek miedzi
-AGCL: Srebrny chlorek
-Zncl2: Chlorek cynku
-CDCL2: Chlorek kadmu
-HGCL2: Chlorek rtęciowy
-Alcl3: Chlorek aluminiowy
-NABR: bromek sodu
-KBR: Bromid potasowy
-CSBR: bromek cezu
-CDBR: bromek kadmu
-Mgbr2: Bromek magnezu
-SRBR2: Bromide Strontium (ii)
-Ki: potassum Yoduro
-Nai: jodek sodu
-CSI: CESium Yoduro
-Ali3: Jodek aluminiowy
-PKB2: Ołowiany jodek (ii)
-NAF: fluor sodu
-LIF: fluor litowy
-CAF2: Fluor wapnia
-PTF2: Fluor platyny (ii)
-NAS2: Sulfid sodu
-Li4C: Węglenie litowe
-Mg2C: Węglenie magnezowe
-ALP: aluminiowy fosfuro
-Tak3N4: Silikon nitruro
-TIN: Titanum Nitrluro
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (czwarta edycja). MC Graw Hill.
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Julián Pérez Porto i María Merino. (2016). Definicja soli haloidowych. Definicja.z. Odzyskane z: definicja.z
- James p. Birk. (5 czerwca 2019). Halogenku ins. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Wikipedia. (2020). Halogenku. Źródło: w:.Wikipedia.org
- « Właściwości nadtlenków, nomenklatura, zastosowania, przykłady
- Charakterystyka termohigometru, funkcje, części, użycia »

