Właściwości nadtlenków, nomenklatura, zastosowania, przykłady
- 1910
- 118
- Maksymilian Kępa
nadtlenki Są to wszystkie te związki chemiczne, które zawierają grupę perokso, O-O, albo kowalencyjnie powiązane z atomami węgla lub innymi grupami funkcjonalnymi lub w postaci jonowej, takich jak anion nadtlenku, lub22-. Powyższe jest reprezentowane graficznie na poniższym obrazku. W nim grupa O-O wyróżnia się niebieskim kolorem.
Mogą występować nadtlenki organiczne, takie jak diquilpertlesidy (r1-O-o-r2;1Co-O-O-r2). Mamy również nieorganiczne nadtlenki, takie jak nadtlenki metali (mN+ALBO22-) i nadtlenek wodoru (H-O-H). Ten ostatni jest najbardziej znany ze wszystkich, otrzymując nazwę nadtlenku wodoru.
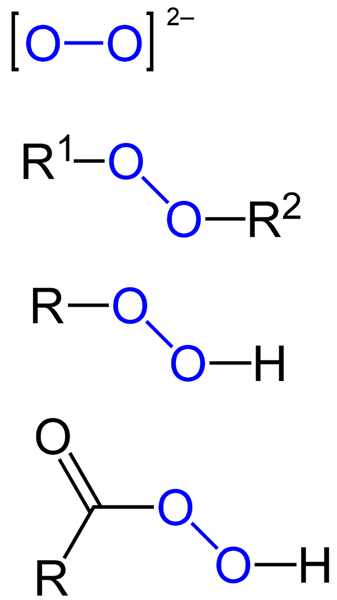 Formuły dla różnych rodzajów nadtlenków, które istnieją. Źródło: Jü / Public Domena
Formuły dla różnych rodzajów nadtlenków, które istnieją. Źródło: Jü / Public Domena Wszystkie nadtlenki dzielą wspólną właściwością bycia bardzo reaktywnymi, utleniającymi, a w niektórych przypadkach, wybuchowych. O ile nie są one określone przez ich syntetyzację, są uważane za niechciane i niebezpieczne zanieczyszczenia w wielu procesach przemysłowych i dla syntezy laboratoryjnej.
Ogólnie nadtlenki to doskonałe środki utleniania, bielenie, bakterycydenty i aktywatory polimeryzacji poprzez tworzenie wolnych rodników. Właśnie dlatego są to zwykle bardzo przydatne odczynniki lub dodatki w branży polimerów, a także w przemyśle spożywczym w celu przyspieszenia utleniania i eliminowania bakterii.
[TOC]
Właściwości nadtlenku
Struktura
Struktury nadtlenku koncentrują się wokół grupy O-O. Każdy atom tlenu ma hybrydyzację SP3, Więc linki -o -Do nie spoczywa w tej samej płaszczyźnie. Na przykład w przypadku nadtlenku wodoru H-O-H kąt utworzony między dwoma H wynosi 115.5, co pokazuje, że cztery atomy nie są w płaszczyźnie.
Zniekształce tego i innych kątów będą zależeć od tożsamości innych fragmentów molekularnych powiązanych z grupą O-O.
Może ci służyć: Gibbs Free Energy: Jednostki, jak jest obliczane, rozwiązane ćwiczeniaZ drugiej strony nadtlenki organiczne i nieorganiczne (z wyjątkiem metalicznego) można rozpoznać gołym okiem, jeśli grupa O-O jest szczegółowo opisana w ich konstrukcji, takich jak dwie szklanki z „jamy ustnej”. W ten sposób każdy nadtlenek jest natychmiast identyfikowany z pojedynczym widokiem jego struktury.
Reaktywność
Link O-O jest stosunkowo słaby w porównaniu z innymi linkami, takimi jak C-H lub C-O. Dlatego ma tendencję do łamania lub fragmentu, aby wytwarzać wysoce reaktywne natlenione rodniki.
Wynikają one z tych rodników, że nadtlenki są klasyfikowane jako substancje reaktywne i niebezpieczne, ponieważ mogą uszkodzić tkanki i jakąkolwiek materię organiczną w ogóle.
Działanie utleniające
Nadtlenki to potężne środki utleniające, starając się zyskać elektrony z środowiska, aby przekształcić w wodę, tlen lub wodorotlenki. Na przykład nadtlenek wodoru jest silniejszym środkiem utleniającym niż ten sam permanganan potasu.
To działanie utleniające służy do wykrywania ich poprzez reakcję z siarczanem żelaza i tiocyjanianu potasu:
Nadtlenek +wiara2+ + Scn- → Fe (SCN)N(3-N)- (N = 1 do 6).
Kompleks utworzony między wiarą3+ i SCN- Jest czerwony krew, więc obserwacja tego koloru odpowiada pozytywnemu testowi obecności nadtlenków w próbce.
Wrażliwość
Nadtlenki to substancje wrażliwe na wysokie temperatury i światło słoneczne. Dlatego muszą być przechowywane w bezpiecznych miejscach oraz w plastikowych i nieprzezroczystych pojemnikach, aby światło nie wpłynęło bezpośrednio na nie bezpośrednio.
Nomenklatura
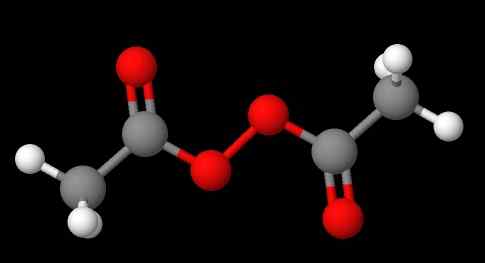
Nomenklatura nadtlenków zależy od tego, który typ należą. Ogólnie rzecz biorąc, wielu powołuje się na wspomnienie „nadtlenku”, a następnie zastępców R w kolejności alfabetycznej. Na przykład związek CH3C (o) OOC (o) CH3 (niższy obraz) nazywa się nadtlenkiem diacetylu lub acetylu, ponieważ ma grupę acetylową na każdym końcu.
Może ci służyć: siarczan sodu (Na2SO4): struktura, właściwości, stosowanie, uzyskiwanie Nadtlenek diacetylu. Źródło: Gabriel Bolívar przez Molview.
Nadtlenek diacetylu. Źródło: Gabriel Bolívar przez Molview. Związek c6H5C (o) Ooc (o) c6H5 (Niższy obraz), z drugiej strony, nazywa się to nadtlenek Dibenzoílo lub Benzoílo, z tych samych powodów podanych w poprzednim akapicie.
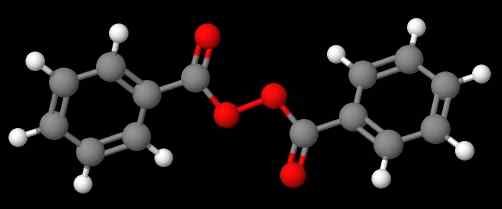 Nadtlenek benzoilu. Źródło: Gabriel Bolívar przez Molview.
Nadtlenek benzoilu. Źródło: Gabriel Bolívar przez Molview. Tymczasem związek C6H5C (o) OOC (o) CH3 nazywa się nadtlenkiem acetylu benzolelolu. Tym razem najpierw wymieniony jest podstawnik acetyl. Innym przykładem jest CH3Ch2Ooc6H5, nazywany nadtlenkiem etylowo -fenylowym.
Podobnie kontynuuj wodoronadoksydami. Na przykład Cho3OOH nazywa się hydroperoksydem metylu.
Szkolenie
Niektóre nadtlenki mogą być utworzone bezpośrednio przez ekspozycję omawianej substancji z tlenem powietrza, wspomaganym lub nie w katalizatorach metalowych. Mogą również tworzyć się, narażając substancję na ozon pod pewnymi warunkami, przeprowadzając reakcję ozonolizy.
Kolejną syntetyczną drogą jest reakcja nadtlenku wodoru za pomocą alkilorysiarczanu:
R2południowy zachód4 + H2ALBO2 → R-O-R +H2południowy zachód4
W celu syntezy lub utworzenia nadtlenków diachilowych, a nawet cyklicznych nadtlenków.
Tymczasem kilka metod tworzenia nadtlenków metali opiera się na natlenianiu ich odpowiednich tlenków metali, tak że „tlenu” i przechodzą od MO (MN+ALBO2-) Miłość2 (MN+ALBO22-).
Stosowanie nadtlenków
Inicjatorzy polimeryzacji
Nadtlenki, zwłaszcza nadtlenki organiczne, są dodawane do średnich reakcji do syntezy nieskończoności tworzyw sztucznych i materiałów, takich jak polistyren, silikon, żywice epoksydowe i akrylowe, chlorek winylu, włókno szklane, między innymi.
Wynika to z faktu, że cierpią one rozkładu termiczne, aby stać się natlenionymi wolnymi rodnikami, które z kolei wyzwalają i katalizują polimeryzacje. Dlatego są pożądane w branży polimerowej.
Może ci służyć: ułamek molowy: jak jest obliczany, przykłady, ćwiczeniaNiektóre z nadtlenków stosowanych jako inicjatory to nadtlenek metylowy (MEK) i nadtlenek acetonu.
Wybielacz i dezynfekujący
Nadtlenki to środki wybielające, stosowane do papieru wybielania i miazgi mąki. Są to również środki dezynfekujące, całkowicie skuteczne, ale agresywne pod względem eksterminacji bakterii. Klasyczny przykład odpowiada nadtlenkowi wodoru, przeznaczonemu w rozcieńczonych roztworach (3%) w celu dezynfekcji ran.
Utleniacze
Nadtlenki są również środkami utleniającymi, więc znajdują wiele zastosowań w syntezie organicznej substancji bardzo natlenionych.
Źródła tlenu
Chociaż nie należy do jego głównych zastosowań, nadtlenki mogą również służyć jako źródła tlenu w niektórych swoich rozpadach. Tak jest, znowu, nadtlenku wodoru.
Przykłady nadtlenków
Wreszcie, niektóre przykłady nadtlenków zostaną wymienione, zarówno organiczne, jak i nieorganiczne, z ich formułami i odpowiednimi nazwami:
-H2ALBO2: Wodór lub nadtlenek wodoru
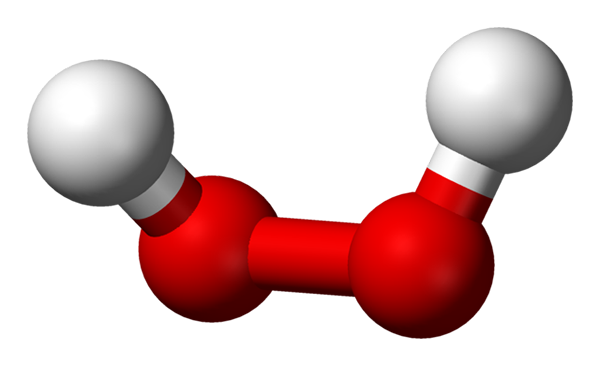 Cząsteczka nadtlenku wodoru reprezentowana za pomocą modelu sfer i słupków. Źródło: Benjah-BMM27 przez Wikipedia.
Cząsteczka nadtlenku wodoru reprezentowana za pomocą modelu sfer i słupków. Źródło: Benjah-BMM27 przez Wikipedia. -Na2ALBO2: nadtlenek sodu
-Belka2: nadtlenek baru
-C6H5C (rozdz3)2OOH: Cummeno Hydroperoksyd
-(NH4)2S2ALBO8: Persulfate amonu
- Ho3Sooso3H: kwas peroksydizulfurowy
-(Ch3)3COOC (rozdz3)3: Nadtlenek diterta-butylowy
Bibliografia
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. (10th Wydanie.). Wiley Plus.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2020). Organiczny nadtlenek. Źródło: w:.Wikipedia.org
- Elsevier b.V. (2020). Nadtlenek. Scientedirect. Pobrano z: Scientedirect.com
- Zaawansowany rozwój chemii. (S.F.). Alkohole, fenole i ich pochodzą:
- Reguła nadtlenków C-218. Odzyskane z: acdlabs.com
- Vol'nov i.Siema., Petrocelli a.W. (1966) Klasyfikacja i nomenklatura nieorganicznych związków nadtlenku. W: Petrocelli a.W. (Eds) nadtlenki, nadtlenki i ozonidy metali alkalicznych i alkalicznych. Springer, Boston, MA.
- « Typowy Baja California Sur dla mężczyzn i kobiet (opis)
- Haloidowe nieruchomości sprzedaży, nomenklatura, jak są one tworzone, przykłady »

