Podstawowe sole formuły, właściwości, nomenklatura, przykłady

- 3632
- 661
- Herbert Wróblewski
podstawowe sole Są to wszystkie, które rozpuszczają się w wodzie, generują roztwory o wartościach pH większych niż 7. Wyjaśnia to formacja OH Ion-, które pochodzą bezpośrednio z procesu rozpuszczania lub równowagi hydrolizy, w której uczestniczy anion.
Podstawowe sole zawierają anion oh- W ich stałych. Na przykład wodorotlenki alkaliczne, takie jak sód i potas, NaOH i KOH, są uważane za członków tych soli; chociaż są wyjątkowo żrące, dlatego zasługują na nominał wodorotlenków zamiast być nazywany solami.
 Wodorotlenek sodu jest przykładem podstawowej soli
Wodorotlenek sodu jest przykładem podstawowej soli Inne podstawowe sole mają zamiast tego aniony, takie jak węglan, co32-. Węglan wywodzi się z kwasu węglowego, h, h2WSPÓŁ3, Słaby kwas. Dlatego sole węglanowe, takie jak węglan wapnia stosowany w zobojętniach kwas, są klasyfikowane jako sole podstawowe. To samo rozumowanie dotyczy wodorowęglanu sodu, Nahco3, I dla wszystkich innych soli wodorowęglanowych.
Podstawowe sole są ważne, ponieważ kilka z nich pomaga zneutralizować kwasowość żywności. Można je również użyć do przygotowania roztworów tłumienia do alkalicznego pH.
[TOC]
Definicje
Podstawowe sole mają dwie definicje, które się uzupełniają: zawierają one aniony- W swoich ciałach stałych lub generuj te same aniony wodorotlenowe, gdy ich kryształy rozpuszczają się w wodzie.
Niezależnie od wybranej definicji, pH jego wodnych roztworów będzie większa niż 7, a zatem będą one alkaliczne lub podstawowe.
Ogólna formuła podstawowych soli
Wyjaśniono, co rozumiane przez podstawową sól, jej formuła, choć nie ściśle ogólna, jest następująca:
MN(OH)WXov
Gdzie m jest kationem metalicznym lub amonowym, oh hydroksylowie i xo anion pochodzący z słabego lub silnego kwasu. Klodowce N, W I v Ile odpowiednio M, Oh i Xo tworzy podstawową sól, a także ich proporcje.
Zauważ, że v Może być równy zero, co oznacza, że mamy wodorotlenek alkaliczny lub alkaliczny. Tak dzieje się z Naoh i Koh. Podobnie, W Może być zero, co oznacza, że nie ma jonów oh-. Na przykład CACO3 Nie ma OH-, A jednak pozostaje podstawową solą.
Może ci służyć: siarczk wapnia (CAS): struktura, właściwości, uzyskiwanie, użyciaZ powyższego stwierdzono, że ogólna formuła podstawowych soli wynosi mN(OH)WXov, Ale nie wszystkie sole są zgodne z tym. Dlatego ważniejszym czynnikiem, który należy wziąć pod uwagę, jest charakter anionu Xo. Zatem będzie wiadomo, gdy sól jest podstawowa, niezależnie od tego, czy ma jony- W swoich formułach.
Podstawowe właściwości soli
Podstawowe sole rozpuszczają się w wodzie po następującym równaniu:
MN(OH)WXov(s) → NM+(AC) + WOh-(AC) + vXo-(AC)
Zauważ, że po rozpuszczeniu uwalnia jony OH- w wodzie. Wpływa to na pH roztworu, stając się alkalicznym o wartości większej niż 7. Na przykład podstawowy azotan wapnia rozpuszcza się w wodzie w zależności od tego, jak go następuje:
CA (OH) Nie3(s) → Ca2+(AC) + OH-(ac) + no3-(AC)
Wartości N, W I v Są równe 1 dla tej soli.
Z drugiej strony podstawowe sole, które nie mają OH-, Ale anion pochodzący ze słabego kwasu jest hydrolizowany w wodzie:
Złodziej3(s) → Ca2+(AC) + CO32-(AC)
WSPÓŁ32-(AC) + H2Lub (l) ⇌ HCO3-(AC) + OH-(AC)
Zauważ, że produktem tej hydrolizy jest anion OH-. Stamtąd leży zasadowość tych baz. I zgodnie z oczekiwaniami, są one mniej podstawowe niż te, które już mają jony- obecne w ich kryształach. Na przykład NaOH jest wyjątkowo podstawowy:
Naoh (s) → na+(AC) + OH-(AC)
Cóż, uwolnij jony- bezpośrednio, gdy tylko woda się dotknie; Lub gorzej, ledwo dotyka wilgoci skóry.
Może ci służyć: karbokacja: formacja, cechy, typy, stabilnośćInne właściwości fizyczne lub chemiczne soli podstawowych nie różnią się zbytnio od właściwości innych soli neutralnych lub kwasowych.
Nomenklatura
Nomenklatura podstawowych soli zależy od charakteru anionu XO: jeśli jest to monoatomowe lub jeśli jest to oksoanion. Jednak ta sekcja skupi się szczególnie na podstawowych soli z anionami OH-. Ci, którzy ich nie mają, mają znacznie łatwiejsze nomenklatury do zapamiętywania lub rozumu.
Z anionami monoatomicznymi
Aniony monoatomiczne nie są reprezentowane jako xo, ale jako x. Pochodzą z hydracedu HX, takiego jak kwas fluorkowy, HF lub kwas chlorowy, HCl i tak dalej.
W takich przypadkach są one systematycznie wymieniane na dwa sposoby:
(Prefiks liczbowy z wyjątkiem małpy) Nazwa hydroksi + anion kończąca się na sufiks -uro + nazwa metalu z jego wartościowością w nawiasach (jeśli ma więcej niż jeden)
Na przykład sól ni (OH) CL nazywa się hydroksychlorkiem niklu (ii).
Nazwa aniona z terminem -uro + -(prefiks liczbowy oprócz małpy) Hydroksyd + metalowa nazwa i jego wartościowość w nawiasach
Na przykład sól Ni (OH) CL można również nazwać niklu chlorkiem-hydroksydem (ii).
Mamy również tradycyjną nomenklaturę, czasem zmieszaną z systematycznym:
Nazwa anionowa, a następnie (prefiks liczbowy z wyjątkiem małpy) podstawowy i nazwa metalu z sufiksami -ooso lub -ico zgodnie z zastosowaniem.
Na przykład Ni (OH) CL nazywa się chlorkiem podstawowym niklu lub podstawowym chlorkiem niklu (ii).
Z oksoanionami
Systematyczna nomenklatura dla soli podstawowych, które mają oksoaniony, jest nieco bardziej skomplikowana. Jednak najprostsza wersja jest zbudowana w następujący sposób:
(Prefiks liczbowy) wodorotlenek- (nazwa aniona) + z + metalowej nazwy i jej walencji w nawiasach
Na przykład wiara (oh) nie3 nazywa się: azotan żelidowo-tlenku (II).
Ma również tradycyjną nomenklaturę:
Podstawowy Nion + (prefiks liczbowy) Nazwa + nazwa metalowa kończąca się w -oso lub -ico
Może ci służyć: tlen: właściwości, struktura, ryzyko, użyciaZatem wiara (oh) nie3 Nazywa się to: podstawowy azotan żelazny lub podstawowy azotan żelaza (ii).
Szkolenie
Podstawowe sole są produktem neutralizacji kwasowo-zasadowych, szczególnie między hydracją lub okacidem o nadmiarze podstawy lub wodorotlenku:
Podstawa (nadmiar) + kwas → podstawowa sól lub alkaliczna + woda
Na przykład CA (OH) nie3 Powstaje przez neutralizowanie kwasu azotowego z nadmiarem wodorotlenku wapnia:
CA (OH)2(Nadmiar) + hno3 → Ca (OH) Nie3 + H2ALBO
Kolejna formacja szkolenia byłaby następująca:
Wiara (OH)3(Nadmiar) + H2południowy zachód4 → Fe (OH) SO4 + 2h2ALBO
Ta sól nazywa się: podstawowy siarczan żelazowy, podstawowy siarczan żelaza (III) lub wodorotlenek żelaza (iii).
Przykłady podstawowych soli
 Zobojętniają się, takie jak węglan wapnia, CACO3, są przykładami soli podstawowych. Źródło: Pixabay.
Zobojętniają się, takie jak węglan wapnia, CACO3, są przykładami soli podstawowych. Źródło: Pixabay. Wreszcie, niektóre inne przykłady podstawowych soli zostaną wymienione razem z ich prostszymi nazwami:
-Nach3COO: octan sodu
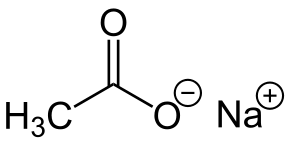 Octan sodowy
Octan sodowy -Na2S: Sulfid sodu
 Siarczka sodu
Siarczka sodu -KCN: cyjanek potasowy
-MGCO3: węglan magnezu
-Wiara (och) tak3: Podstawowy sulfit żelaza (iii)
-Wiara (OH) (c6H5Gruchać)2: Podstawowy żelazo benzoan (iii)
-Aucl (OH)2: Złoty chlorek dibasowy (iii)
-Cuclo3(OH): podstawowy chloran miedziany (ii)
-W (Oh) So4: Podstawowy siarczan aluminiowy
-PB (OH)2WSPÓŁ3: Węglan ołowiu dibasic (IV)
Problem podstawowych soli polega na tym, że nie wszystkie z nich można przygotować, ponieważ nadmiar podstaw lub wodorotlenku nie wystarczy, aby je skrystalizować bez uciekania się do innych procesów. Tak jest w przypadku PB (OH)2WSPÓŁ3. Jednak ten węglan istnieje jako biały pigment ołowiu (II), którego wzór jest 2pbco3· PB (OH)2 lub Pb3(OH)2(WSPÓŁ3)2.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2020). Sól alkaliczna. Źródło: w:.Wikipedia.org
- Wu c., Dowell c. & Hooper n. (1 lipca 2014 r.). Właściwości kwasowo-bazowe soli. Odzyskane z: chem.Librettexts.org
- Nicola McDougal. (2020). Kwaśne i podstawowe roztwory soli: Wyjaśnienie i przykład. Badanie. Odzyskane z: Study.com
- Problem i ćwiczenia chemiczne. (S.F.). Podstawowe sole. Odzyskane z: acorral.Jest
- « Koncepcja i przykłady struktura materialna
- Złapane charakterystyka funkcji, przykłady, ćwiczenia »

