Reguła oktetu

- 2338
- 644
- Gabriela Łuczak
 Reprezentacja cząsteczki dwutlenku węgla wykazująca zgodność z zasadą oktetu
Reprezentacja cząsteczki dwutlenku węgla wykazująca zgodność z zasadą oktetu Jaka jest reguła oktetu?
Reguła oktetu Jest to praktyczna zasada, która wyjaśnia tworzenie wiązania chemicznego reprezentatywnych elementów na podstawie konfiguracji elektronicznej jej warstwy walencyjnej.
Zgodnie z tą zasadą atomy łączą się ze sobą w taki sposób, że każdy atom jest otoczony ośmioma elektronami w warstwie walencyjnej (stąd słowo oktet).
Zasada ta została opublikowana jednocześnie w 1.916 Zarówno Gilbert Lewis, jak i Walther Kossel. Odzwierciedla obserwację, że gazy szlachetne są bardzo stabilne i wszystko, z wyjątkiem helu, charakteryzują się ich posiadaniem warstwy walencyjnej z 8 elektronami.
Teoria określa, że atomy udostępniają lub wymieniają elektrony poprzez tworzenie wiązań chemicznych, aby nabyć tę pełną konfigurację elektroniczną -warstwową.
Reguła oktetu i struktury Lewisa
Reguła oktetów i struktury Lewisa są ściśle powiązane. Wynika to z faktu, że reguła oktetu jest jedną z zasad zrozumienia tworzenia wiązania chemicznego, więc pozwala przewidzieć w większości przypadków, strukturę chemikaliów Lewis.
W tym sensie jednym z podstawowych kroków do narysowania struktury Lewisa, po umieszczeniu prostych powiązań między wszystkimi atomami tworzącymi cząsteczkę, jest rozkład pozostałych elektronów walencyjnych wśród najbardziej elektrowni w celu uzupełnienia ich oktetów.
W przypadkach, w których oktety są bez napełniania, tworzone są podwójne lub potrójne wiązania, zawsze szukając reguły oktetu dla jak największej liczby atomów. Tak więc ta empiryczna zasada jest niezbędna do budowy struktur Lewisa.
Może ci służyć: srebrny yoduro (agi): struktura, właściwości, uzyskiwanie, użyciaPrzykłady zgodności z zasadą oktetu
Reguła oktetu jest stosowana głównie do reprezentatywnych elementów, to znaczy do bloków S i P w tabeli okresowej. Zasada ta jest konsekwentnie stosowana do związków zawierających węgiel, azot, tlen i halogeny oraz z pewnymi wyjątkami od innych elementów bloku P. Jednak większość metali przejściowych nie jest zgodna.
Niektóre przykłady związków, w których reguła oktetu jest wypełniona dla wszystkich atomów, to:
Dwutlenek węgla (co2)
Jak widać w strukturze Lewisa dwutlenku węgla przedstawionego poniżej, zarówno centralny węgiel, jak i oba atomy tlenu są zgodne z zasadą oktetu.
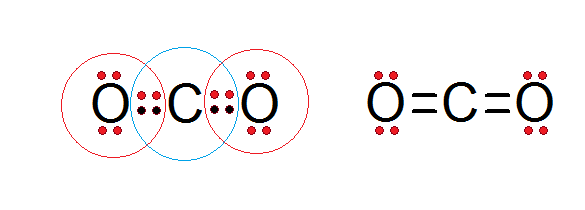
Węgiel jest otoczony 4 elektronami walencyjnymi, a także dwa elektrony z każdego tlenu, które przyczyniają się do utworzenia podwójnych wiązań C = O, podczas gdy każdy tlen jest otoczony 6 własnymi elektronów oraz parą z węgla.
Neopentano (c5H12)
W zdecydowanej większości związków organicznych wszystkie atomy spełniają zasadę oktetu (z wyjątkiem wodoru, który jest otoczony tylko 2 elektronami). Obejmuje to alkany, takie jak neopentano lub 2.2-dimetylopropan:
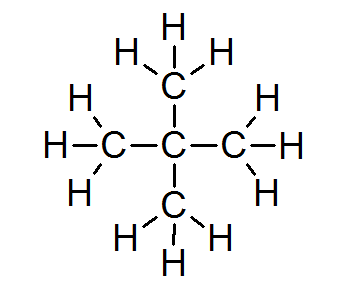
W tym przypadku można również zauważyć, że każdy atom węgla dzieli cztery elektrony z 4 sąsiednimi atomami, z których każdy zapewnia jeden z jego elektronów, tworząc 4 proste kowalencyjne wiązania, które utrzymują razem.
Z tego powodu każdy atom węgla jest otoczony 8 elektronami walencyjnymi, zgodne z zasadą oktetu.
Może ci służyć: Energia aktywacjiTlenek węgla (CO)
Tlenek węgla to kolejny związek molekularny, w którym tlen i węgiel mają elektrony tworzące kowalencyjne wiązanie w celu spełnienia reguły oktetu.
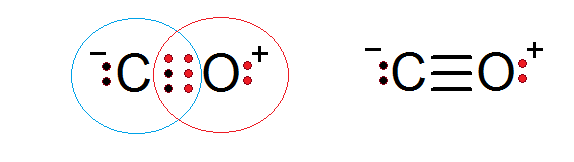
W takim przypadku węgiel zapewnia dwa elektrony i tlen 4 do wypełnienia 6 elektronów wymaganych do utworzenia potrójnego kowalencyjnego wiązania, które je łączy. Każdy z dwóch atomów ma dodatkowe elektrony bez dzielenia się, które uzupełniają każdy okett.
Anion azotanowy (nie3-)
Również w przypadku jonów reguła oktetu jest spełniona. Jon azotanu ma centralny atom azotowy otoczony 3 atomami tlenu.
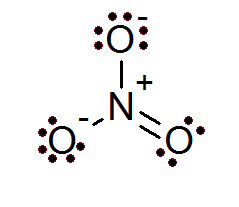
Jak widać w tym przypadku, wszystkie atomy mają pełny okett, dwa tlenu mają ujemne obciążenie formalne, podczas gdy azot ma dodatnie obciążenie formalne, co powoduje obciążenie netto jon azotanu -1.
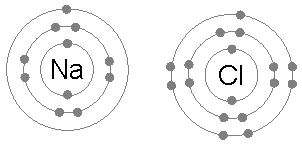
Chlorek sodu (NaCl)
Wymiana elektronów z tworzeniem związków jonowych jest również wspólnym przykładem zastosowania reguły oktetu.
Kiedy chlorek sodu powstaje z chloru i sodu, zaczyna się od dwóch atomów, które nie są zgodne z zasadą oktetu, ponieważ sod na elektronu i chloru nie ma jednego do ukończenia oktetu.
Następnie sód podaje elektron do chloru, pozostawiając kation otoczony 8 elektronów, a z kolei uzupełniając okT do chloru, tworząc jon chlorkowy.
 Wyjątki od reguły Octet
Wyjątki od reguły Octet
Tak jak istnieje duża liczba związków, w których wszystkie atomy spełniają regułę oktetu, istnieje również wiele przykładów atomów, które nie są z nią zgodne.
Może ci służyć: potencjalne z: wartości, stopnie krzepnięcia, determinacja, użyciaNiektóre są otoczone mniej niż 8 elektronami, więc są biedne gatunki elektronów, podczas gdy inne są otoczone ponad ośmioma elektronami, w którym to przypadku mówi się, że ma rozszerzony okett lub nazywa się Hipervalent Atom.
Przykłady biednych gatunków elektronów
Bordean (Bh3)
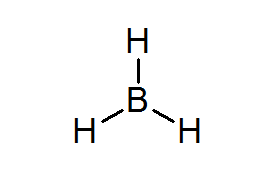
Ten związek jest typowym przykładem słabych elektronów. Ani bor, ani otaczające hydrogeny, nie mają wystarczającej liczby elektronów, aby zaspokoić zasadę oktetu w środkowym atomie. To powoduje, że bor otrzymuje kilka elektronów z innego atomu w innej cząsteczce, zamieniając Bordeal w kwas z Lewisa.
Aluminiowy triclur (ALCL3)
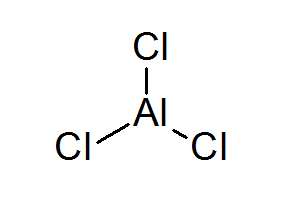
ALCL3 Jest to kolejny przykład kwasu Lewisa, który zawdzięcza jego zachowanie chemiczne, do którego nie spełnia reguły oktetu.
Przykłady gatunków hiperkaluentu
Siarka heksakloruro (SF6)
Typowym przykładem rozszerzonego oktetu jest SF6, który jest zwykle reprezentowany jako środkowa siarka z 6 prostymi kowalencyjnymi wiązaniami z atomami fluorowymi. W tym przypadku siarka jest otoczona 12 elektronami walencyjnymi zamiast 8, więc narusza zasadę oktetu.
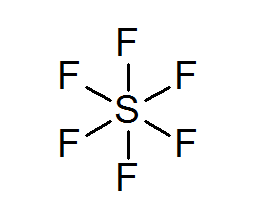
Mimo to zaproponowano modele, w których siarka jest faktycznie powiązana z wiązaniami kowalencyjnymi z 4 fluorami jednocześnie, podczas gdy z pozostałymi dwoma tworzą wiązania jonowe. Jeśli tak, spełniłoby to zasadę oktetu.
Pentachlorek fosforu (PCL5)
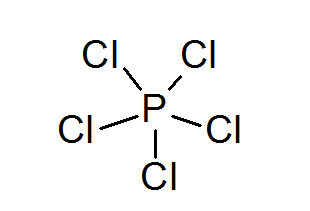
Podobnie jak w przypadku siarki, fosfor może również tworzyć związki z rozszerzonymi oktetami, w tym przypadku otoczone 10 elektronów.

