Zasada Aufbau

- 2362
- 521
- Filip Augustyn
 Orbitale atomowe wypełniające zamówienie zgodnie z zasadą Aufbau
Orbitale atomowe wypełniające zamówienie zgodnie z zasadą Aufbau Jaka jest zasada Aufbau?
On Zasada Aufbau, Znana również jako reguła deszczowa lub zasada konstrukcyjna, jest to praktyczna zasada, która pozwala przewidzieć konfigurację elektroniczną zdecydowanej większości elementów tabeli okresowej, a także konfiguracji jej jonów.
Ta zasada określa, że gdy protony są dodawane do jądra, jeden po drugim do sukcesywnego budowy każdego elementu chemicznego, elektrony są również dodawane sukcesywnie do dostępnych orbitali atomowych najmniejszych energii.
Innymi słowy, Aufbau ustalił, że istnieje określone zamówienie, zgodnie z którym można wypełnić orbitale atomowe. To zamówienie zostało wyjaśnione poniżej.
Kolejność wypełniania orbitali zgodnie z zasadą Aufbau
Kolejność wypełniania orbitali atomowych zależy od ich poziomu energii. Złota zasada polega na tym, że poziomy energii są wypełnione od najmniejszych do największych, tak jakby był to budynek, w którym apartamenty powinny być wypełnione najniższymi podłogami, aby uzyskać dostęp do najwyższych podłóg.
W tym sensie, aby przewidzieć kolejność wypełniania orbitali, musimy najpierw wiedzieć, w jaki sposób są one zamówione zgodnie z ich poziomem energii. W analogii budynku oznacza to wiedzę, które (orbitalne) mieszkania są na każdym piętrze.
Poniższa grafika pokazuje poziomy energii pierwszych orbitali atomowych zamówionych od najniższej do większej energii.
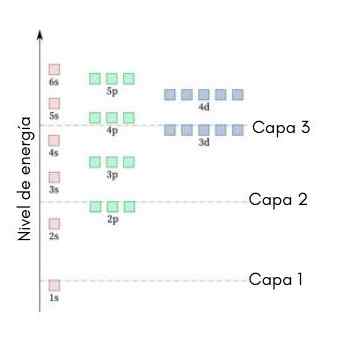
Na tym obrazie każde zdjęcie reprezentuje konkretny orbital, w którym pasują tylko 2 elektrony. Każda grupa obrazów w tym samym kolorze reprezentuje sub -poziom energii.
Te podwładki są identyfikowane przez liczbę i literę (1s, 3p, 3d itp.). Liczba wskazuje główny poziom energii, podczas gdy litera wskazuje rodzaj orbity, który tworzy grupę.
Może ci służyć: chlorek aluminiowy (ALCL3)Zgodnie z tym schematem, pierwszym podpokrenem, który musi być wypełniony, to 1s (najmniej energii ze wszystkich), a następnie przychodzi, 2s, 2p, 3s, 3p, 4s, 3D i tak dalej.
Reguła deszczu
Pomimo tego, jak łatwo jest ustalić kolejność wypełnienia, jeśli masz wykres taki jak poprzedni, trudno jest zapamiętać konkretną kolejność, w jakiej idą różne poziomy. W tym celu używa się niektórych „reguły deszczu”.
Ta zasada składa się z dwóch prostych kroków:
Krok 1
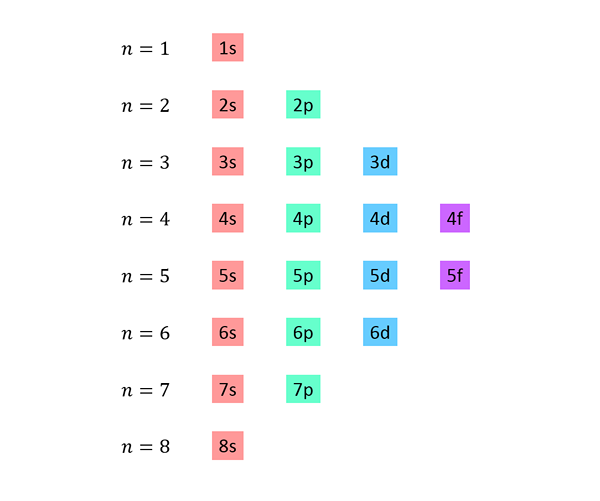
Wykonana jest lista, w której każda linia odpowiada poziomowi energii i zawiera jeden po drugim, wszystkie podgWAny dostępne na tym poziomie energii.
Na przykład pierwsza linia odpowiada poziomowi 1 (n = 1) i zawiera jedynie 1S podpisów; Druga linia odpowiada poziomowi n = 2 i zawiera podwodne 2S i 2p; Trzeci zawiera podmioty 3S, 3p i 3D i tak dalej.
Pełna lista wygląda tak:
Krok 2
Zstępujące przekąski są rysowane od prawej do lewej, jeden poniżej drugiego, jak pokazano poniżej.
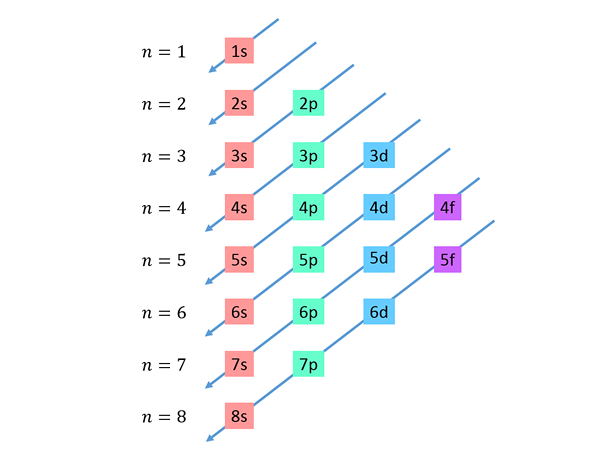
Linie te przypominają trasę kropli wody podczas wiatru z wiatrem, więc ten wykres jest zwykle nazywany „metodą deszczu”. Kolejność wypełniania jest określona przez kolejność, w której te przekątne dotykają podwładców na liście.
Na podstawie poprzedniej liczby kolejność energii orbitali, a zatem kolejność, w jakiej należy je wypełnić, wynosi:
Może ci służyć: stół kwantowy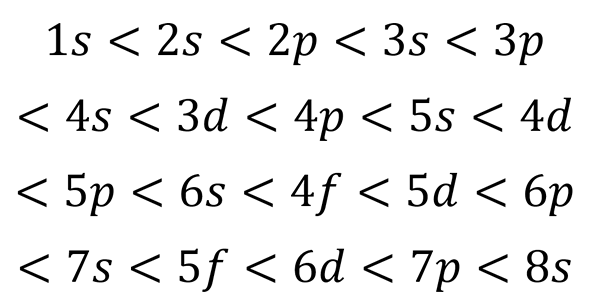
Ta kolejność wypełniania jest jedyną, która naprawdę ma znaczenie podczas pisania konfiguracji elektronicznej atomu. Podczas wypełniania tych poziomów należy pamiętać, że na poziomie podrzędnym S w pasujących tylko 2 elektrony P dopasuj 6, w D Pasują 10 i w F Pasują 14.
Wyjątki na początku Aufbau
Zasada Aufbau wyraźnie określa, że podpisu nie można wypełnić, dopóki wszystkie poprzednie poziomy podwodne nie zostaną całkowicie wypełnione. Istnieją jednak pewne wyjątki od tej zasady.
W niektórych przypadkach atom woli mieć podsumowanie energii wypełnione dokładnie na połowę niż mieć niepełny, który nie jest pełny na pół. W takich przypadkach faktyczna konfiguracja elektroniczna atomu nie odpowiada przewidywanej kolejności metodą deszczu.
Na przykład, zgodnie z zasadą Aufbau, atom chromowy powinien mieć konfigurację elektroniczną, która kończy się na 4s2 3d4. Jednak jego prawdziwa konfiguracja wynosi 4s1 3d5 ponieważ tak podmioty 4S i 3D są wypełnione na pół, podczas gdy w drugiej konfiguracji nr.
To samo dotyczy miedzi, której konfiguracja kończy się na 4s1 3d10, zamiast 4s2 3d9, Ponieważ zatem wypełnia się podpisanie D i S jest pełne na pół.
Przykłady zastosowania zasady Aufbau
Następnie istnieje 5 przykładów elementów, które spełniają zasadę Aufbau:
Przykład 1: Konfiguracja elektroniczna sodu
Sód to element 11, więc ma 11 protonów i 11 elektronów. Jego konfiguracja elektroniczna wynosi 1s2 2s2 2 p6 3s1.
Przykład 2: Konfiguracja elektroniczna Argonu
Argon (AR) to element 18, więc ma 18 protonów i 18 elektronów. Jego konfiguracja elektroniczna wynosi zatem 1s2 2s2 2 p6 3s23p6. Można zauważyć, że jego poziomy podrzędne i podwodne P były całkowicie.
Może ci służyć: propylen (C3H6)Przykład 3: Elektroniczna konfiguracja galu
Gali (GA) to element 31, więc ma 31 protonów i 31 elektronów. Jego konfiguracja elektroniczna wynosi 1s2 2s2 2 p6 3s23p64s23d104p1.
Można to zapisać w sposób podsumowujący jako [AR] 4s23d104p1, gdzie [AR] reprezentuje elektroniczną konfigurację argonu przedstawioną w poprzednim przykładzie.
Przykład 4: Konfiguracja węgla elektronicznego
Węgiel (c) to element 6, więc ma 6 protonów i 6 elektronów. Jego konfiguracja elektroniczna wynosi 1s2 2s2 2 p2.
Przykład 5: Elektroniczna konfiguracja chloru
Chlor (CL) to element 17. Jego 17 elektronów jest dystrybuowane zgodnie z następującą konfiguracją elektroniczną: 1s2 2s2 2 p6 3s23p5 lub [ne] 3s23p5.
Dodatkowe przykłady wyjątków na początku Aufbau
Następnie istnieją 2 dodatkowe przykłady elementów, które naruszają zasadę Aufbau:
Przykład 6: Konfiguracja elektroniczna Molybdenum
Molybdenum (MO) to element 42. Pierwsze 36 elektronów jest dystrybuowane w taki sam sposób jak w krypton. Zamiast konfiguracji elektronicznej [KR] 5S24d4, Jego konfiguracja to [KR] 5S14d5, Podobne do tego, co dzieje się z Chrome.
Przykład 7: Srebrna konfiguracja elektroniczna
La Plata (AG, Element 47) przedstawia naruszenie zasady Aufbau podobnego do naruszenia miedzi. Jego konfiguracja elektroniczna to [KR] 5S14d10 Zamiast [kr] 5s24d9.

