Powinowactwo elektroniczne

- 2827
- 86
- Bertrand Zawadzki
Co to jest powinowactwo elektroniczne?
Powinowactwo elektroniczne Jest zdefiniowany jako ilość energii uwalnianej, gdy mol atomów w stanie gazowym jest połączona z molem elektronów, tworząc kret anionów, również w stanie gazowym. Innymi słowy, odnosi się do negatywu odmiany entalpii następującego procesu:
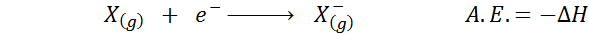
Jak sama nazwa wskazuje, powinowactwo elektroniczne (a.I.) Jest to miara trendu, która ma atom, aby dołączyć do elektronu. To znaczy mierzy powinowactwo atomu do elektronów.
Interpretacja powinowactwa elektronicznego
Ze względu na sposób jego zdefiniowania wysokie powinowactwo elektroniczne sugeruje, że zmienność entalpii jest bardzo ujemna. To z kolei wskazuje, że proces jest energetycznie korzystny i że produkty są bardziej stabilne niż odczynniki. Z tego powodu możemy również powiedzieć, że powinowactwo elektroniczne jest pośrednią miarą stabilności anionu.
Im większe elektroniczne powinowactwo atomu, tym większy trend tworzenia anionu. Właśnie dlatego atomy, takie jak chlor, którego powinowactwo elektroniczne wynosi 349 kJ/mol, mają tendencję do tworzenia anionów (w tym przypadku anionu chlorku), podczas gdy inne atomy, takie jak magnez, którego elektroniczne powinowactwo jest ujemne, nie tworzą anionów, nie tworzą anionów, nie tworzą anionów, nie tworzą anionów anionów, nie tworzą anionów anionów, nie tworzą anionów anionów, nie tworzą anionów anionów, nie tworzą anionów anionów.
Wyjaśnienie energii elektronicznej i energii jonizacji
Wiele razy myślisz o powinowactwie elektronicznym jako przeciwieństwie energii jonizacji (tendencja atomu gazowego do utraty elektronu), ale tak nie jest. Rozważmy na przykład atom x.
Może ci służyć: tusfrano: struktura chemiczna, właściwości i zastosowaniaJego elektroniczne powinowactwo odnosi się do zmiany energii procesu pokazanego powyżej w pierwszym równaniu. Jednak jego energia jonizacji odnosi się do zmiany energii, gdy atom traci elektron:
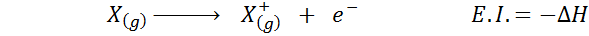
Chociaż ta reakcja wydaje się być przeciwną reakcją na poprzedni.
Co determinuje powinowactwo elektroniczne?
Aby wiedzieć, jakie cechy atomu wpływają na wartość jego powinowactwa elektronicznego, należy wziąć pod uwagę stabilność pierwotnego atomu. Jeśli anion jest bardziej stabilny niż atom, wówczas powinowactwo elektroniczne będzie wysokie, w przeciwnym razie będzie niski lub nawet ujemny.
Ale jak wiedzieć, który z dwóch gatunków jest bardziej stabilny? W tym celu polegamy na dwóch czynnikach:
- Elektroniczna Konfiguracja. Istnieją bardziej stabilne ustawienia elektroniczne niż inne. Zasadniczo konfiguracja pełnej warstwy (np. Gazy szlachetne) jest najbardziej stabilna ze wszystkich. Następnie następuje konfiguracja warstwy półllena, w której wszystkie orbitale warstwy Walencji mają połowę elektronów, które mogłyby mieć (na przykład 4s14p3).
- Odpychanie elektroniczne. Jeśli porównano anion obciążenia -1 z anionem obciążenia -2, w drugim przypadku będzie znacznie więcej odpychania między elektronami, co destabilizuje anion.
Okresowa tendencja powinowactwa elektronicznego
 Wykres pokazujący elektroniczne powinowactwa pierwszych 9 elementów stolika okresowej
Wykres pokazujący elektroniczne powinowactwa pierwszych 9 elementów stolika okresowej Powinowactwo elektroniczne jest jedną z okresowych właściwości pierwiastków. Oznacza to, że jest to właściwość, która zmienia się przewidywalnie w zależności od elementu w zależności od jego pozycji w tabeli okresowej. Ogólnie rzecz biorąc, powinowactwo elektroniczne rośnie wraz ze spadkiem wielkości atomu.
Może ci służyć: formuła rozwiniętej na półprzestrzeni: co to jest i przykłady (metan, propan, butan ...)W tym sensie wielkość atomów różni się w zależności od okresu i grupy, w której się znajduje, więc jego elektroniczne powinowactwo różni się również, jak wyjaśniono poniżej:
Zmienność powinowactwa elektronicznego w danym okresie
Przynajmniej dla reprezentatywnych elementów (tych należących do bloków S i P w tabeli okresowej), można zaobserwować, że powinowactwo elektroniczne ma ogólną tendencję do wzrostu od lewej do prawej, ze względu na wzrost efektywnego obciążenia jądrowego jest w stanie przyciągnąć elektrony z większą siłą.
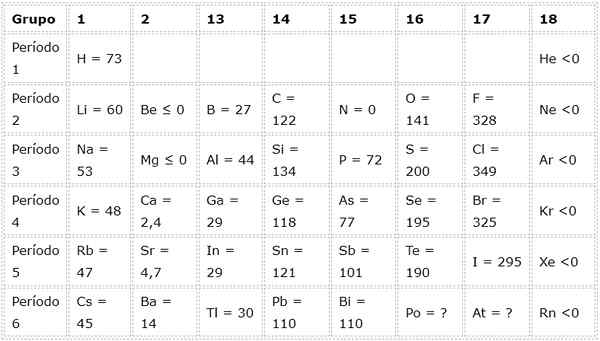
Na przykład, jeśli weźmiemy 3. okres okresowej tabeli, widzimy, że elektroniczne powinowactwo Li (60 kJ/mol) jest mniejsze niż tlen (141 kJ/mol) i jest to mniejsze niż fluoryd (328 kJ /mol).
Wyjątki
Poprzednia zasada nie zawsze jest spełniona.
Po pierwsze, podczas przechodzenia z metali alkalicznych do alkaliniastów, powinowactwo elektroniczne zmniejsza się. Jest tak, ponieważ w przypadku metali alkalicznych (konfiguracja elektroniczna NS1) Korzystne jest uchwycenie elektronu, ponieważ skończyliby wypełniać swój orbital.
W przypadku alkalineros (konfiguracja elektroniczna NS2) uchwycenie elektronu jest niekorzystne, ponieważ mają już pełną orbital. To samo dzieje się podczas przechodzenia od halogenów (które mają elektroniczne powinowactwo wszystkich elementów) do gazów szlachetnych.
Zmienność powinowactwa elektronicznego w całej grupie
W przypadku grup zachowanie jest jeszcze mniej przewidywalne. Ogólna zasada polega na tym, że a.I. wzrasta od dołu do góry, w tym samym kierunku, który zmniejsza promień atomowy. W przypadku metali alkalicznych i halogenowych zasada ta jest całkiem dobrze spełniona. Jednak nie dzieje się tak w przypadku większości innych grup.
Może ci służyć: wodorotlenek kobaltuPrzykłady elektronicznego powinowactwa niektórych reprezentatywnych elementów
Poniższa tabela pokazuje wartości powinowactwa elektronicznego w (kJ/mol) Reprezentatywne elementy Posortowane według grupy:
Poniżej znajdują się kilka przykładów powinowactwa elektronicznego wraz z reakcją, do której się odnoszą:
1. Wodorowe powinowactwo elektroniczne
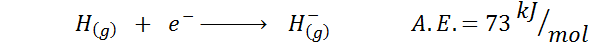
2. Elektroniczne powinowactwo tlenu
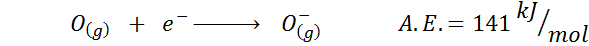
3. Anion elektroniczny powinowactwo
Innym powszechnym przykładem jest przypadek elektronicznego powinowactwa anionu, takiego jak lub-. A.I. W takim przypadku jest to podawane przez energię związaną z następującym procesem:
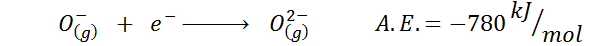
Jak widać, to elektroniczne powinowactwo jest silnie negatywne, nawet jeśli jon lub2- Ma elektroniczną konfigurację neonową (szlachetny gaz) i jest bardzo powszechnym jonem w wielu jonowych stałych.
Powodem jest to, że odpychanie negatywnych ładunków w OR2- destabilizuje ten jon stanu gazowego, ale w stanie stałym obciążenie stabilizuje się przez otaczające go kationów.

