Zasada zlewu lub maksymalna mnogość

- 687
- 44
- Maksymilian Kępa
Wyjaśniamy, jaka jest zasada lub zasada maksymalnej mnogości, kroki, aby ją zastosować i podać kilka przykładów
 Źródło: Gabriel Bolívar
Źródło: Gabriel Bolívar Jaka jest zasada zlewu?
Zasada zlewu, Nazywana także zasadą spinu maksymalnego mnogości, jest to reguła empiryczna, która jest używana do napisania bezwzględnej konfiguracji elektronicznej elementów chemicznych, gdy są one w swoim podstawowym stanie. Oznacza to, że jest to zasada, która pomaga przewidzieć, w jaki sposób elektrony są rozmieszczone w orbitalach atomowych atomu, który jest rozluźniony lub na najniższym poziomie energii.
Reguła Sink mówi:
„… W atomie, który jest w jego podstawowym stanie, elektronom o tym samym poziomie energii zostaną rozmieszczone w taki sposób, że jest jak najwięcej równoległych kolców”.
Zasada ta odpowiada jednej z podstawowych zasad mechaniki kwantowej i aktualnej teorii atomowej. Bardzo przydatne jest zrozumienie niektórych właściwości różnych elementów, zwłaszcza ich właściwości magnetycznych. Wynika to z faktu, że atomy są przyciągane lub odpychane przez magnesy, ponieważ zniknęły elektrony w swojej strukturze.
Skąd pochodzi zasada zlewu lub maksymalna mnogość?
Widma atomowe
Ta zasada najpierw wypowiedziała niemieckiego fizyka Friedricha Hund w 1927 roku. Zlew badał atomowe widma absorpcyjne, które pozwalają eksperymentalnie pomiar energii, którą elektrony pochłaniają po wystawieniu na promieniowanie elektromagnetyczne o odpowiedniej długości fali. Obserwacje eksperymentalne można wyjaśnić tylko wtedy, gdy atom posiadał jak najwięcej elektronów z tym samym spinem.
Brakujące elektrony
Oprócz widm atomowych istnieją inne obserwacje eksperymentalne, które potwierdzają konfiguracje elektroniczne przewidywane przez zastosowanie zasady HUND. Najważniejsze składa się z eksperymentalnych miar właściwości magnetycznych atomów, które pozwalają określić, ile brakujących elektronów ma atom.
Może ci służyć: elektroliza wodyBrakujące elektrony to te, które są same na orbicie, bez ich przeciwnej pary spin.
Kroki w celu zastosowania zasady zlewu
Zasada zlewu ma zastosowanie, gdy piszemy konfigurację elektroniczną atomu w jego podstawowym stanie. Oznacza to, że jest to uzupełniająca zasada innych zasad, takich jak zasada lub zasada konstrukcyjna Aufbau (zwana także zasadą deszczu) i zasadą wykluczenia Pauli.
Dotyczy tylko tych przypadków, w których chcemy.
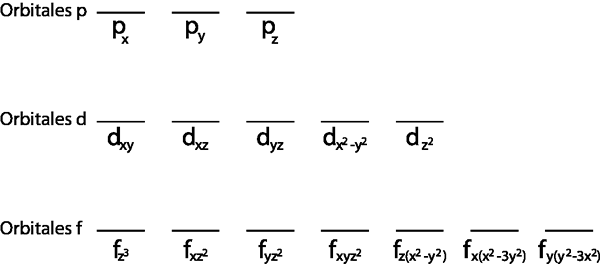
Ponadto sensowne jest zastosowanie go tylko dla warstwy Walencji, to znaczy tego poziomu energii, który jest niekompletny (nie ma wszystkich elektronów, które pasują do niego). W przeciwnym razie wszystkie elektrony zostałyby sparowane w celu spełnienia zasady wykluczenia Pauli.
Zastosowanie tej zasady składa się z następujących kroków:
- Krok 1: Narysuj linię poziomą lub mały prostokąt dla każdego orbita.
- Krok 2: Umieść pierwszy elektron na pierwszym orbicie z skierowanym spinem.
- Krok 3: Umieść następujący elektron na następnym orbicie, również wskazując.
- Krok 4: Kontynuuj tak, aż elektrony się nie skończą lub nie ma już pustych orbitali.
- Krok 5: Jeśli podczas umieszczania elektronu na każdym orbicie nadal są rozmieszczone elektronę, powtórz kroki 2 do 4.
Aby zrozumieć, w jaki sposób obowiązują te kroki, przeanalizujmy kilka przykładów.
Przykład 1: Konfiguracja elektroniczna azotu
Azot jest elementem numer 7, więc ma w sumie 7 elektronów obracających się wokół jądra. Te elektrony są rozmieszczone w następujący sposób, zgodnie z zasadą deszczu:
Może ci służyć: acetanylide (C8H9NO)1s2 2s2 2 p3
Jak widzimy, warstwa wartościowości azotu odpowiada poziomowi 2 energii (zwanej warstwą L), w której pasuje 8 elektronów. Jednak azot ma tylko 5 elektronów Valencia.
W orbitalach S Dopasowane tylko 2 elektrony, więc Orbital 2S jest całkowicie pełny i nie ma sensu stosować zasady zlewu dla tego orbity.
Z drugiej strony podpisa 2p, która zawiera 3 orbitale, nie jest pełne. Ale w jaki sposób te 3 elektrony są rozmieszczone w tych trzech orbitalach? Są one dystrybuowane zgodnie z krokami zasady zlewu, które przedstawiono poniżej:
Krok 1: Narysuj linię poziomą lub mały prostokąt dla każdego orbita.
Ponieważ jest to poziom 2p, istnieją trzy orbitale, które są 2pX, 2 pI i 2pz. Musimy więc narysować trzy poziome paski lub trzy pudełka lub prostokąty:
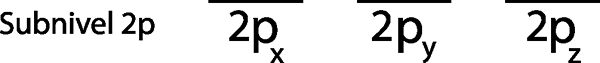
Każdy z tych pasków lub pudełek reprezentuje orbital, na co wskazuje nazwa, która ma każdy z nich.
Krok 2: Umieść pierwszy elektron na pierwszym orbicie z skierowanym spinem.
Umieszczamy pierwszy elektron na orbicie 2pX Ponieważ jest to pierwszy orbital na liście.
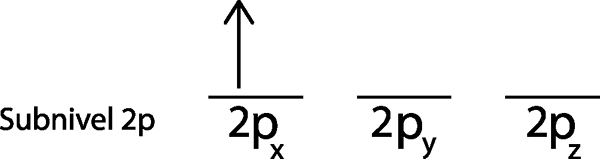
Krok 3: Umieść następujący elektron na następnym orbicie, również wskazując.
Drugi elektron znajduje się na orbicie 2pI
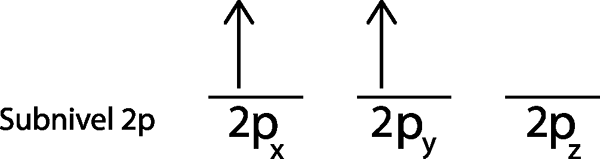
Krok 4: Kontynuuj tak, aż elektrony się nie skończą lub nie ma już pustych orbitali.
W naszym przypadku musimy tylko rozpowszechniać 3 elektron, więc musimy po prostu umieścić ostatni elektron w ostatnim orbicie i voila:
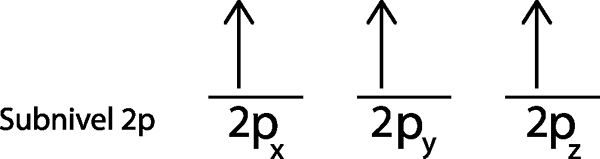
Jak widać, zasada maksymalnej mnogości lub zasady zlewu przewiduje, że azot atomowy musi mieć 3 brakujące elektron.
Może ci służyć: tlenki azotu (NOX)W takim przypadku nie było konieczne stosowanie kroku 5, ponieważ po kroku 4 zostaliśmy bez elektronów do dystrybucji.
Przykład 2: Konfiguracja elektroniczna żelaza
Żelazo to element 26, a jego konfiguracja elektroniczna to:
1s2 2s2 2 p6 3s2 3p6 3d6 4s2
W takim przypadku możemy zauważyć, że orbital o najwyższym poziomie energii wynosi 4s, ale ponieważ jest to metal przejściowy, żelazo ma częściowo pełną orbital d. To jest orbita.
Krok 1: Narysuj linię poziomą lub mały prostokąt dla każdego orbita.
Wypełnimy poziom 3D, który zawiera 5 orbitali:
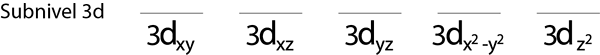
Krok 2: Umieść pierwszy elektron na pierwszym orbicie z skierowanym spinem.
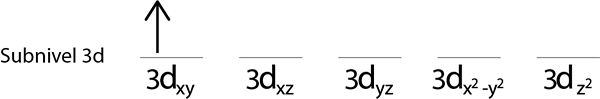
Kroki 3: Umieść następujący elektron na następujący orbital, również wskazując.
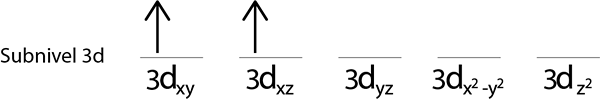
Krok 4: Kontynuuj tak, aż elektrony się nie skończą lub nie ma już pustych orbitali.
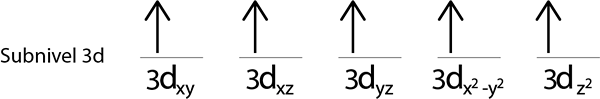
Krok 5: Jeśli podczas umieszczania elektronu na każdym orbicie nadal są rozmieszczone elektronę, powtórz kroki 2 do 4.
Ponieważ nadal mamy elektron do dystrybucji po umieszczeniu elektronu na każdym orbicie 3D, ostatni z 6 elektronów jest umieszczony z przeciwnym spinem na pierwszym orbicie.
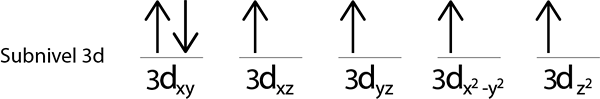
Jest to bezwzględna konfiguracja atomu żelaza w jego podstawowym stanie. W tym samym żelaza ma 4 brakujące elektronę z równoległymi kolcami.
Bibliografia
- Bez odpowiedzi na pytania dotyczące maksymalnej reguły mnogości lub zlewu: co należy zrobić (2020). Zaczerpnięte z Physis Andquimica.com.
- Zlew - Chemia (2021). Pobrane z CostProject.org.
- Maksymalna mnogość Sind (2020). Zaczerpnięte z Principiode.com.
- Reguła zlewu | The Chemistry Guide (2012). Zaczerpnięte z chemii.Laguia2000.com.

