Charakterystyka proliny, struktura, funkcje, żywność
- 4614
- 1472
- Maksymilian Kępa
Prolina (Pro, p) należy do 22 aminokwasów sklasyfikowanych jako podstawowy. Jest to nieistotne aminokwas, ponieważ może być syntetyzowany przez człowieka i inne zwierzęta ssakowe.
W 1900 r. Jednak w 1901 r. Emili Fischer wymyślił termin „prolina” oparty na pierścieniu pirolidyny aminokwasu; Ten badaczowi udało się również szczegółowo wyjaśnić syntezę proliny z kazeiny mlecznej.
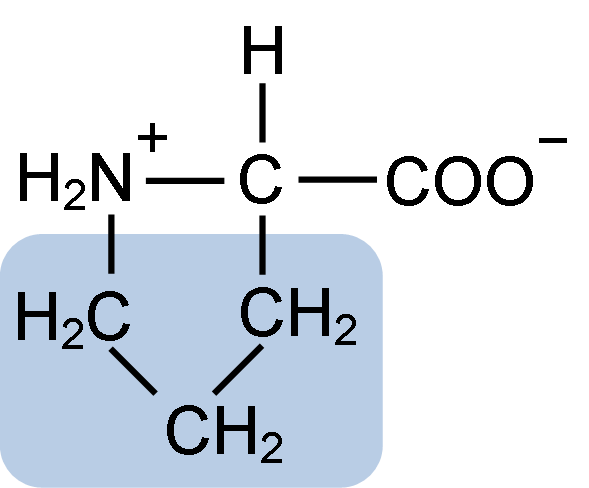
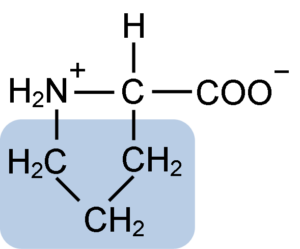 Struktura chemiczna aminokwasu proliny (źródło: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons)
Struktura chemiczna aminokwasu proliny (źródło: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons) W białkach takich jak kazeina prolina ma niezbędną funkcję w „turach” i składaniu strukturalnym. W tym białku prolina jest jednorodnie rozmieszczana w całej strukturze i łączy się z kazeiną β i białkiem αS1; Ponadto zapobiega wadliwe pętle strukturalne lub składanie.
W analizach biochemicznych stosowanych obecnie do określenia dokładnej sekwencji aminokwasów, które tworzą białka, prolina jest jednym z najtrudniejszych aminokwasów wykrywających, ponieważ wtórna grupa aminowa proliny ma inne zachowanie i nie można ich łatwo wykryć.
Scurvy jest prawdopodobnie najbardziej znaną chorobą związaną z proliną. Ma to związek z niedoborem spożycia witaminy C, co bezpośrednio wpływa na hydroksylację proliny we włóknach kolagenowych, co powoduje osłabienie ogólnoustrojowe z powodu niestabilności włókien kolagenowych w całym ciele.
[TOC]
Charakterystyka
Wtórna grupa aminowa α wtórna, sprawia, że zadanie klasyfikacji proliny jest nieco trudne. Jednak w niektórych tekstach jest to klasyfikowane obok rozgałęzionych aminokwasów lub z alifatycznymi łańcuchami bocznymi, ponieważ łańcuch boczny lub r r proliny jest hydrofobowy lub alifatyczny.
Jedną z najważniejszych cech proliny jest to, że w żadnym wypadku nie mogą tworzyć mostu wodoru, co sprawia, że idealnie nadaje się do struktury złożonych i skomplikowanych zwrotów w trzeciorzędowych strukturach białek.
Podobnie jak wszystkie aminokwasy mają dwie izoform, które zależą od centralnego atomu węgla, prolina można znaleźć w naturze. Jednak Form L-Prolina jest najliczniejsza z natury i jest częścią struktur białkowych.
W białkach, w których się znajduje, prolina często zajmuje miejsca w pobliżu powierzchni lub fałdu lub „obrotu” łańcucha polipeptydowego, ponieważ sztywna i zamknięta struktura proliny utrudnia silną interakcję z innymi interakcją aminokwasową.
Struktura
Prolina ma szczególną strukturę między podstawowymi aminokwasami, ponieważ przedstawia grupę aminową (NH2) wtórną, a nie pierwotną grupą aminową, która jest charakterystyczna dla wszystkich aminokwasów.
Grupa R lub łańcuch boczny proliny to pierścień pirolidyny lub tetrahydropirrol. Ta grupa powstaje przez heterocykliczną aminę (bez podwójnych wiązań) pięciu atomów węgla, w których każdy z nich jest nasycony atomami wodoru.
Prolina ma osobliwość, że „centralny” atom węgla jest uwzględniony w heterocyklicznym pierścieniu pirolidyny, więc jedynymi „wolnymi” lub „wybitnymi” atomami są grupa karboksylowa (COOH) i atom wodoru (H) heterocyklicznego pierścienia pierścienia z aminokwas.
Może ci służyć: dysmutaza nadtlenkowa: charakterystyka, struktura, funkcjeMolekularna wzór proliny to C5H9NO2, a jej nazwa IUPAC to kwas pirrolidyna-2-karboksylowy. Ma przybliżoną masę cząsteczkową 115,13 g/mol, a jego częstotliwość wyglądu w białkach wynosi około 7%.
Funkcje
Włókna kolagenowe i tropocollagen są najliczniejszymi białkami u większości zwierząt kręgowców. Te składają się na skórę, ścięgna, matrycę kostną i wiele innych tkanek.
Włókna kolagenowe składają się z wielu potrójnych wyzwalaczy polipeptydowych, które z kolei składają się z wielu reszt proliny i glicyny w sekwencji glicyny-proliny-proliny/hydroksyprololiny (ten ostatni jest zmodyfikowaną pochodną proliny).
W swojej rodzimej postaci prolina jest częścią prokollagenu, jest to prekursor polipeptydów kolagenu i niektórych innych białek tkanki łącznej. Hydroksylaza enzymu proliny.
Jaka jest główna funkcja proliny we włóknach kolagenowych?
Hydroksyprolina daje charakterystykę oporności na kolagen, ponieważ ta pochodna aminokwasowa ma zdolność do tworzenia dużej liczby mostów wodorowych między potrójnymi łańcuchami śmigła, które tworzą białko.
Enzymy katalizujące hydroksylację odpadów proliny wymagają obecności witaminy C (kwas askorbinowy) i, jak wspomniano powyżej, szkor jest spowodowany osłabieniem włókien kolagenowych z powodu awarii hydroksylacji odpadów proliny, co powoduje zmniejszenie mosty wodorowe, które podtrzymują włókna kolagenowe.
Inne funkcje
Prolina jest niezbędna do tworzenia fałd i zakrętów białkowych.
Jego zamknięta struktura utrudnia „pomieścić” białka wewnętrzne, ponieważ nie może tworzyć mostów wodoru w celu „oddziaływania” z innymi pobliskimi odpadami, indukuje tworzenie „zakrętów” lub „zakrętów” wzdłuż struktury białek gdzie to się znajduje.
Wszystkie białka o krótkim czasie życia mają przynajmniej region z obfitą powtarzaną proliną, glutaminianem, serynem i tononiną. Regiony te przechodzą od 12 do 60 odpadów i nazywane są sekwencjami szkodników.
Białka zawierające sekwencję szkodników są oznaczone przez ubikwitynację do późniejszej degradacji proteosomy.
Biosynteza
Wiele aminokwasów można zsyntetyzować z pośredników glikolizy, fosforanu pentozowego lub cyklu kwasu cytrynowego (cykl Krebsa). Prolina i arginina powstają na krótkich trasach glutaminianowych.
Praktycznie powszechna biosyntetyczna droga dla wszystkich żywych organizmów zaczyna się od konwersji l-glutaminianu w fosforan γ-L-glutamil-5-fosforan dzięki działaniu enzymu glutaminian-5-Quinous (w bakteriach) lub przez γ-glutamil- Whinas (u ludzi).
Ta reakcja implikuje fosforylację zależną od ATP, więc oprócz głównego produktu generuje się cząsteczka ADP.
Reakcja katalizowana przez glutaminian 5-limidową dehydrogenazę (u bakterii) lub przez fosforan reduktazy γ-glutamil (u ludzi) przekształca obecność γ-L-glutamil-5-5-fosforan w L-glutaminian-5-sumid-limid CO -COFORTOR NADPH.
Może ci służyć: pół Stuart: fundament, przygotowanie i zastosowaniaL-glutamato-5-semialdehyd jest odwracalny i spontanicznie odwodniony do (S) -1-1-pirrool), w których reakcji konieczna jest również cząsteczka NADPH lub NADH.
Degradacja
Prolina, arginina, glutamina i histydyna są stale degradowane do α-zetoglutaranu, aby wejść do cyklu kwasu cytrynowego lub cyklu Krebsa. W szczególnym przypadku proliny jest to najpierw utleniane przez enzym oksydazy proliny do pirrolin-5-karboksylanu.
W pierwszym etapie, w którym występuje utlenianie proliny do pirrolin-5-karboksylanu, odłączone protony są akceptowane przez E-FAD, zmniejszając się do E-FADH2; Ten krok dotyczy wyłącznie aminokwasów proliny.
Z powodu spontanicznej reakcji pirrolin-5-karboksylan jest przekształcany w glutaminian γ-semialdehydu, który następnie służy jako substrat dla enzymu glutaminianu γ-sumidowego dehydrogenazy. W tym kroku pojawiają się dwa protony, jeden z nich jest akceptowany przez NAD, który jest zredukowany do NADH, a drugi jest wolny w postaci H+.
Arginina, podobnie jak prolina, jest przekształcana w glutaminian γ-semialdehydu, ale poprzez alternatywną trasę metaboliczną, w której uczestniczą dwa różne enzymy.
Dehydrogenaza glutaminianowa γ-semialdehydów przekształca glutaminian γ-semialdehyd w L-glutaminian. Następnie ten l-glutaminian jest ponownie utleniony przez enzym dehydrogenazę glutaminianową, która ostatecznie tworzy α-zetoglutaran, który zostanie włączony do cyklu kwasu cytrynowego.
W przejściu utleniania glutaminianu proton (H+) jest uwalniany i grupa aminowa (NH3+). Proton zmniejsza grupę NADP+ i pochodzi cząsteczka NADPH.
Pomimo licznych podobieństw między trasami degradacji i biosyntezy proliny i argininy, aminokwasy te są syntetyzowane i degradowane przez całkowicie przeciwne trasy, które wykorzystują różne enzymy, różne kofaktory i które występują w różnych przedziałach wewnątrzkomórkowych.
Pokarmy bogate w Walinę
Ogólnie rzecz biorąc, wszystkie pokarmy o wysokiej zawartości białka mają duże ilości proliny. Wśród nich są mięso, mleko, jajka i inne. Jednak gdy nasze ciało jest w optymalnym stanie zdrowia i odżywiania, jest w stanie syntetyzować endogenny prolinę.
Prolina można również znaleźć w wielu roślinach strączkowych i orzechów oraz na na przykład w pełnych ziaren, takich jak płatki owsiane. Inne pokarmy proliny to między innymi otręby pszeniczne, orzechy, migdały, groszek, fasola.
Niektóre sklepy naturystyczne zwykle sformułowały sprężone z aminokwasów L-lizina i L-Prololina połączone, aby pomóc osobom z problemami stawowymi lub opóźnić starzenie się tkanek.
Nie wykazano jednak na pewno, że spożywanie suplementów diety tych aminokwasów ma znaczący wpływ na opóźnienie starości lub innych warunków postępu wieku.
Korzyści z Twojego spożycia
Diety bogate w prolinę są zwykle przepisywane osobom z chorobami stawowymi, takimi jak zapalenie stawów, skręcenia, pękanie więzadła, zwichnięcia, zapalenie ścięgien i inne, i jest to spowodowane ich związek z syntezą włókien kolagenowych obecnych w tkankach łącznych ciała.
Może ci służyć: agar m.R.S: Co to jest, podkład, przygotowanie, użycieWiele płynów farmakologicznych i tabletek stosowanych w przemyśle estetycznym jest wzbogaconych o L-prolinę, ponieważ niektóre badania wykazały, że aminokwas ten może w jakiś sposób zwiększyć syntezę kolagenu, a zatem poprawić teksturę skóry, przyspieszyć gojenie się ran,, krzyki, wrzody i oparzenia.
W przemyśle spożywczym znajdują się białka, które mają „bioaktywne peptydy”, które ćwiczą funkcjonowanie poza ich właściwościami odżywczymi. Te peptydy mają na ogół od dwóch do dziewięciu odpadów aminokwasowych wśród których obfituje w prolinę, argininę i lizynę.
Te bioaktywne peptydy mogą mieć aktywność przeciwnadciśnieniową z pewnym efektem opioidowym; Mogą działać jako immunomodulatory poprzez stymulowanie odpowiedzi immunologicznej przeciwko niektórym patogenom, a nawet mogą powodować wzrost wazoaktywności, co poprawia krążenie tych, którzy je spożywają.
Zaburzenia niedoboru
Gluten jest białkiem obecnym w ziarnach pszenicy, które powoduje zapalenie jelit. Ludzie cierpiący na „nietolerancję glutenu” są znani jako pacjenci z „celiakią” i wiadomo, że białko to jest bogate w prolinę i glutaminę, których proteolityczna degradacja jest trudna dla osób z takim stanem.
Niektóre choroby mają związek ze złym fałdowaniem ważnych białek i bardzo często te wady mają związek z izomeryzacją Cis-trans z linków amida w odpadach proliny, ponieważ w przeciwieństwie do innych powiązań peptydowych, w których izomer trans Jest to bardzo uprzywilejowane, w prolinie jest w niekorzystnej sytuacji.
W odpadach proliny zaobserwowano, że istnieje znaczna tendencja do tworzenia się izomeru Cis Po pierwsze niż izomer trans W sąsiednich amidach z odpadami proliny, które mogą generować „niepoprawną” konformację białek.
Zaburzenia metaboliczne
Podobnie jak w przypadku innych niezbędnych i nieistotnych aminokwasów, główne zaburzenia patologiczne związane z proliną muszą zwykle robić, z wadami na drogach asymilacji tego aminokwasowego.
Na przykład hiperprolinemia jest typowym przypadkiem niedoboru w jednym z enzymów, które uczestniczą w trasie degradacji proliny, szczególnie w dehydrogenazie 1-piroliny-5-karboksylanu, która prowadzi do akumulacji podłoża, która ostatecznie nieaktywna trasa trasy, która ostatecznie nieaktywna trasa trasy, która ostatecznie nieaktywna trasa trasy, która ostatecznie nieaktywna trasa trasy, która ostatecznie nieaktywna trasa trasy, która ostatecznie nieaktywna trasa trasy, która ostatecznie nieaktywna trasa trasa, która ostatecznie nieaktywna trasa trasa.
Ta patologia jest zwykle diagnozowana przez wysoką zawartość proliny w osoczu krwi i obecność metabolianu 1-pirololin-5-karboksylanu w moczu dotkniętych pacjentów.
Główne objawy tej choroby obejmują zaburzenia neurologiczne, choroby nerek i utraty zdolności słuchowych lub głuchoty. Inne poważniejsze przypadki obejmują poważne opóźnienie umysłowe i wyraźne trudności psychomotoryczne.
Bibliografia
- Abu-Baker, s. (2015). Przegląd biochemii: pojęcia i połączenia
- Delauney, a. J., & Verma, D. P. S. (1993). Biosynteza proliny i osmoregulacja w roślinach. The Plant Journal, 4 (2), 215-223.
- Lista, b., Lerner, r. DO., I Barbas, C. F. (2000). Katalizowane proliną bezpośrednie asymetryczne reakcje aldolu. Journal of the American Chemical Society, 122 (10), 2395-2396
- Nelson, zm. L., Lehninger, a. L., & Cox, m. M. (2008). Zasady biochemii lehninger. Macmillan.
- Plimmer, r. H. DO. (1912). Konstytucja chemiczna białek (vol. 1). Longmans, zielony.
- Szabados, L., & Savouré, do. (2010). Prolina: wielofunkcyjny aminokwas. Trendy w nauce roślin, 15 (2), 89-97.

