Charakterystyka typtoński, struktura, funkcje, korzyści
- 4186
- 519
- Eliasz Dubiel
On Tryptofan (TRP, W) jest aminokwasem sklasyfikowanym w grupie niezbędnych aminokwasów, ponieważ organizm ludzki nie może go zsyntetyzować i musi uzyskać przez dietę.
Niektóre pokarmy, takie jak mleko i ich pochodne, mięso, jaja i niektóre zboża, takie jak komosa ryżowa i soja, zawierają niezbędne aminokwasy, a zatem są ważnym źródłem tryptofanu.
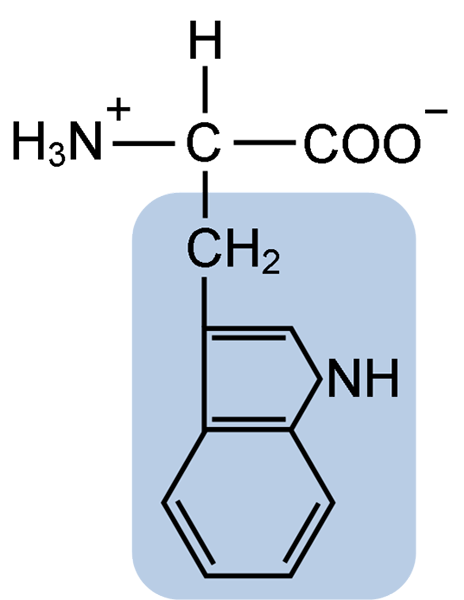
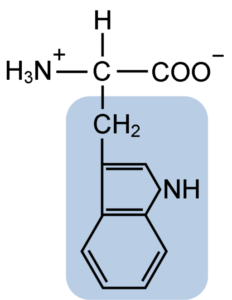 Struktura chemiczna aminokwasu Typtofanu (źródło: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons)
Struktura chemiczna aminokwasu Typtofanu (źródło: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons) W naturze znanych jest ponad 300 różnych aminokwasów, a tylko 22 stanowią monomeryczne jednostki białek komórkowych. Wśród tych ostatnich 9 to niezbędne aminokwasy, w tym tryptofan, jednak istotność każdego z nich różni się między jednym gatunkiem a drugim.
Tryptofan ma różne funkcje, w tym ich udział w syntezie białek, w syntezie serotoniny, która jest potężnym zwężeniem naczyń krwi.
W królestwie roślin tryptofan jest podstawowym prekursorem hormonu roślinnego znanego jako auksyna (kwas indol-3-octowy). Może być zsyntetyzowany przez niektóre bakterie, takie jak I. coli Z Corismato, który jest wytwarzany z niektórych pochodnych glikolityczny.
Jego degradacja u ssaków występuje w wątrobie, gdzie jest stosowana do syntezy koenzymu acetylowego A (acetylo-CoA) i z tego powodu jest opisywana jako aminokwas nazywa glukogenną, ponieważ może wejść do cyklu tworzenia glukozy.
Zgłoszono różne badania z kontrowersyjnymi wynikami związanymi z zastosowaniem tryptofanu jako suplementu diety do leczenia niektórych patologii, takich jak depresja i niektóre zaburzenia snu między innymi.
Istnieją pewne choroby związane z wadami wrodzonymi w metabolizmie aminokwasów. W przypadku typtofanu choroba Hartnupa można mianować z powodu tryptofanu -2,3 -monoksygenazy, recesywnej dziedzicznej choroby, która charakteryzuje się upośledzeniem umysłowym i zmianami typu pelagry typu skóry typu.
[TOC]
Charakterystyka
Wraz z fenyloalaniną i tyrozyną, tryptofan występuje w grupie aromatycznych i hydrofobowych aminokwasów.
Jednak tryptofan charakteryzuje się jako lekko hydrofobowy aminokwas od czasu jego aromatycznego łańcucha bocznego, mając grupy polarne, osłabia tę hydrofobowość.
W przypadku połączonych pierścieni mają silną absorpcję światła w obszarze widma w pobliżu ultrafioletu, a ta charakterystyka jest często stosowana do analizy strukturalnej białek.
Absorbuje światło ultrafioletowe (między 250 a 290 nm) i chociaż ten aminokwas nie jest bardzo obfity w strukturze większości ludzkich białek ciała, jego obecność stanowi ważny wkład dla zdolności absorpcji światła światła w obszarze obszaru 280 nm większości białek.
Dzienne wymagania tryptofanu różnią się wraz z wiekiem. U niemowląt od 4 do 6 miesięcy średnie zapotrzebowanie wynosi około 17 mg na kilogram masy dziennie; U dzieci w wieku od 10 do 12 lat wynosi 3,3 mg na kilogram masy dziennie, a u dorosłych wynosi 3,5 mg na kilogram masy.
Tryptofan jest pochłaniany przez trasę jelitową i jednocześnie jest ketogennym i glikogennym aminokwasem.
Ponieważ jest to prekursor serotoniny, ważny neuroprzekaźnik, tryptofan musi dotrzeć do ośrodkowego układu nerwowego (CNS) i dla tego musi przekroczyć barierę mózgu krwi, dla której istnieje specyficzny aktywny mechanizm transportu.
Może ci służyć: Biggy Agar: fundament, przygotowanie i zastosowaniaStruktura
Tryptofan ma wzór molekularny C11H12N2O2 i ten niezbędny aminokwas ma aromatyczny łańcuch boczny.
Podobnie jak wszystkie aminokwasy, tryptofan ma atom węglowy α przymocowany do grupy aminowej (NH2), atomu wodoru (H), grupy karboksylowej (COOH) i łańcucha bocznego (R) utworzonego przez strukturę heterocykliczną, grupę indolową grupę indolową.
Jego chemiczna nazwa to kwas 2-amino-3-propioniowy, ma masę cząsteczkową 204,23 g/mol. Jego rozpuszczalność w temperaturze 20 ° C wynosi 1,06 g w 100 g wody i ma gęstość 1,34 g/cm3.
Funkcje
W ludzkiej istocie tryptofan jest stosowany do syntezy białek i jest niezbędny do tworzenia serotoniny (5-hydroksytryptamina) potężny zwężanie naczynia krwionośne, stymulując skurcz mięśni gładkich (szczególnie w jelicie cienkim) i neurotransmittera zdolnego do generowania stymulacji psychicznej, depresji zwalczania, depresji zwalczania, depresji zwalczania, depresji zwalczania, depresji zwalczania. i reguluj lęk.
Tryptofan jest prekursorem syntezy melatoniny, a zatem ma implikacje w cyklach snu i czuwania.
Wspomniany aminokwas jest stosowany jako prekursor na jeden z trzech sposobów tworzenia kofaktora NAD, bardzo ważnego kofaktora, który uczestniczy w różnych reakcjach enzymatycznych związanych z zdarzeniami ograniczania tlenku.
Tryptofan i niektóre z jego prekursorów są używane do tworzenia hormonu wegetacyjnego zwanego auksyną (kwas indol-3). Auxiny są hormonami roślinnymi, które regulują wzrost, rozwój i wiele innych fizjologicznych funkcji roślin.
Biosynteza
W organizmach zdolnych do jego syntetyzowania szkielet węglowy tryptofanu wywodzi się z fosfoenolopyrogronianu i erytrosa-4-fosforanu. Te z kolei powstają z pośrednika cyklu Krebsa: szczawian.
Fosfoenolpirogu i erytryn-4-fosforan stosuje się do syntezy korymatów na siedmiu enzymatycznej trasie. Fosfoenolpiroguren (PEP) jest produktem glikolizy i erytrious-4-fosforanu drogi fosforanu pentozowego.
Jak wygląda droga syntez?
Pierwszym etapem objawów Corismato jest połączenie PEP z fosforanem erythrosa-4-fosforanu z utworzeniem 2-ZO-3-DISOXXXXI-D-ANABINO-HEPTULOSONATO-7-FOFOSHAN (DAHP) (DAHP).
Ta reakcja jest katalizowana przez enzym 2-ZO-3-DEXXI-D-ANABINO-HEPTULOSONOTO-7-FOFORANIZOWANIE (DAHP SYNTASA), która jest hamowana przez korytmat.
Druga reakcja implikuje cyklację DAHP przez dehydrochinian syntazy, enzym, który wymaga CO -COFORTOR NAD, który jest zmniejszony podczas tej reakcji; W rezultacie występuje 5-dishydroquate.
Trzeci etap tej trasy implikuje eliminację cząsteczki wody 5-dehydroquinianu, reakcji katalizowanej przez dehydratazę dehydratazy enzymu, którego produkt końcowy odpowiada 5-dishydro sikimato.
Grupa keto tej cząsteczki jest redukowana do grupy hydroksylowej, w wyniku czego powstaje Shikimato. Enzym, który katalizuje tę reakcję, jest zależna od NADPH zależna.
Piąty etap trasy implikuje tworzenie 5-fosforanu Shikimate i spożycie cząsteczki ATP przez enzym znany jako kinaza shikimato, odpowiedzialna za fosforylację shikimate w pozycji 5.
Następnie z 5-fosforanowego shikimate i przez działanie syntazy 3-enlappiruvil shikimato-5-fosforan generuje się 5-fosforan 3-enlappirupilu shikimato. Wyżej wspomniany enzym promuje przemieszczenie grupy fosforylowej drugiej cząsteczki PEP przez grupę hydroksylową węgla w pozycji 5 5-fosforanowych Shikimate.
Może ci służyć: dlaczego ważne jest, aby dbać o różnorodność biologiczną?Siódma i ostatnia reakcja jest katalizowana przez syntazę koronkę, która eliminuje fosforan z 3-enlappate Shikimate 5-fosforan i sprawia, że jest to potory.
W grzybach N. Crassa, Pojedynczy wielofunkcyjny kompleks enzymatyczny katalizuje pięć z siedmiu reakcji tej trasy i ten kompleks dodano trzy inne enzymy, które ostatecznie generują tryptofan.
Synteza tryptofanu u bakterii
W I. coli, Transformacja korporacyjnego tryptofanu obejmuje pięć dodatkowych enzymatycznych trasy:
Po pierwsze, enzym syntazy antranilowej przekształca korytmat w antranien. W tej reakcji uczestniczy cząsteczka glutaminy, przekazana przez grupę aminową, która wiąże się z pierścieniem indolowym tryptofanu i staje się glutaminianem.
Drugi krok jest katalizowany przez antranil fosforribozyloprzepustowy. W tej reakcji cząsteczka pirofosforanu 5-fosforribozylo-1-pirofosforanu (PRPP) (PRPP) porusza się bogato w energię, a N- (5'-fosforribozyl) jest.
Trzecia reakcja tej drogi syntezy tryptofanu implikuje udział enzymu fosforribozyl-izomerazy. Tutaj n- (5'-forbosyl) -santranylan.
Później powstaje fosforan indol-3-glicerolu, w reakcji katalizowanej przez syntazę współczucia indol-3-glicerolu, w której uwalniane są cząsteczka CO2 i H2O oraz 1- (O-karboksyfleloamina) -1- dezoksrybulosa 5-fosforan 5-fosforan.
Ostatnia reakcja tej trasy kończy się na tworzeniu tryptofanu, gdy katalizator syntazy tryptofańskiej.
Degradacja
U ssaków tryptofan jest degradowany w wątrobie do acetylo-CoA na trasie, która obejmuje dwanaście etapów enzymatycznych: osiem do osiągnięcia α-Zo-stoadipatu i 4 więcej, aby przekształcić α-Zo-dotadipato w acetyl.
Kolejność degradacji, aż α-Cetoadipato to:
Typtofan → N-ExiL quinurenina → quinurenina → 3-hydroxi quinurenina → 3-hydroksy-antraniat → ε-sumialdehydehyd 2-amino-3-mukoncycix dużo → ε-sumialdehido α-amino amouzoniconiczne amouzoniconic aukoniczne amouzon.
Enzymy, które katalizują odpowiednio te reakcje, to:
Typtofan 2-3-dioksygenaza, formamidaza quinurenina, zależne od monooksigenazy zależne od NADPH.
Po wygenerowaniu α-cetoadipatu, dekarboksylacja oksydacyjna powstaje. To, przez ß-utlenianie, forma glutaconylo-CoA, która traci atom węgla wodorowęglanowego (HCO3-), wygrywa cząsteczkę wody i kończy się jako crotonil-CoA.
Crotonil-CoA, również do ß-oksydacji, daje acetylo-CoA. Powiedział, że acetylo-CoA może podążać za kilkoma sposobami, w tym glukoneogeneza, tworząc glukozę i cykl Krebsa, aby w razie potrzeby tworzyć ATP.
Jednak tę cząsteczkę można również skierować do tworzenia ciał ketonowych, które można ostatecznie wykorzystać jako źródło energii.
Pokarmy bogate w tryptofan
Ogólnie czerwone mięso, kurczak i ryby (zwłaszcza niebieskie ryby, takie jak łosoś i tuńczyka) są szczególnie bogate w tryptofan. Mleko i jego pochodne, jaja, zwłaszcza żółtka, są również potrawami z dużą ilością treści tryptofan.
Inne pokarmy, które służą jako naturalne źródło tego aminokwasu, to:
- Orzech, takie jak orzechy, migdały, pistacje i anacardos,.
- Zboża ryżowe.
- Suche ziarna, takie jak fasola, soczewica, ciecierzyca, soja, komosa ryżowa itp.
- Drożdże piwne i świeża fasola, banany i banany, ananas lub Ananá, awokado, śliwki, ramy wodne, brokuły, szpinak i czekolada.
Może ci służyć: Shark Submarine: History, Rzeczywistość lub fikcja?Korzyści z Twojego spożycia
Zużycie typtofanu jest absolutnie konieczne do syntezy wszystkich tych białek, które uwzględniają go w jego strukturze i poprzez różne funkcje umożliwia regulację nastroju, snu i cykli czuwania oraz szeroką gamę procesów biochemicznych, w których uczestniczy NAD.
Oprócz znanego wpływu na nastrój, serotonina (pochodna tryptofanu) interweniuje w wielu funkcjach poznawczych związanych z uczeniem się i pamięcią, które są również związane z tryptofanem.
Istnieją dane, które pokazują związek między nastrój, serotoninę i osi przewodu pokarmowego jako system dwukierunkowych wpływów między centrami emocjonalnymi i poznawczymi mózgu a funkcją obwodową przewodu pokarmowego.
Zastosowanie jako suplement diety do leczenia niektórych zaburzeń, zwłaszcza tych związanych z ośrodkowym układem nerwowym, był bardzo kontrowersyjny, ponieważ jego konkurencyjny transport z neutralnymi aminokwasami, znacznie bardziej obfitymi, utrudnia osiągnięcie znacznego i trwałego wzrostu tryptofanu po później jego doustna administracja.
Pomimo tych kontrowersji jego użycie zostało postulowane jako dodatek w:
- Leczenie bólu
- Zaburzenia snu
- Leczenie depresji
- Leczenie manii
- Redukcja apetytu
Zaburzenia niedoboru
Centralnej eliminacji lub braku tryptofanu towarzyszy depresja, niepowodzenia uwagi, zmniejszenie pamięci, snu i zaburzeń lękowych.
U pacjentów z depresją i z trendami samobójczymi stwierdzono zmiany stężenia krwi i płynu mózgowo -rdzeniowego. Ponadto niektórzy pacjenci z nerwową anoreksją wykazują niski poziom tryptofanu w surowicy.
Niektórzy pacjenci z poliurycy, którzy tracą witaminę B6 i cynk, często mają fobię i lęk oraz poprawiają suplementy diety bogate w triptofan.
Zespół rakotwórczy charakteryzuje się obecnością guzów jelitowych, które powodują biegunkę, choroby naczyniowe i zwężenie oskrzeli i jest związane z deficytem niacyny i tripofanowym
Pelagra jest stanem patologicznym, którym towarzyszy biegunka, otępienie, zapalenie skóry i może powodować śmierć, jest to również leczone suplementami niacyny i tryptofanu.
Choroba Hartnupa musi zrobić, wśród niektórych rzeczy, z wadą metabolizmu kilku aminokwasów, w tym tryptofanu.
W przypadku deficytu enzymu typtofanu -2,3-monoksygenazy, jest to recesywna dziedziczna choroba, którą charakteryzuje się upośledzeniem umysłowym i zmianami skóry typu skóry.
Bibliografia
- Halvorsen, k., & Halvorsen, s. (1963). Choroba Hartnup. Pediatria, 31(1), 29-38.
- Hood, s. D., Bell, c. J., Argyropoulos, s. V., & Nutt, D. J. (2016). Panika Dona. Przewodnik po wyczerpaniu tryptofanu z prowokacją lękową specyficzną dla zaburzeń. Journal of Psychopharmacology, 30(11), 1137-140.
- Jenkins, t. DO., Nguyen, J. C., Polglaze, k. I., & Bertrand, p. P. (2016). Wpływ tryptofanu i serotoniny na nastrój i poznanie z możliwą rolą osi stajonowej. Składniki odżywcze, 8(1), 56.
- Kaye, w. H., Barbarich, n. C., Putnam, k., Gendall, k. DO., Fernstrom, J., Fernstrom, m.,… & Kishore, a. (2003). Efekty przeciwlękowe ostrego zubożenia tryptofanu w jadła anoreksji. International Journal of Eating Disorders, 33(3), 257-267.
- Murray, r. K., Granner, zm. K., Mayes, str., & Rodwell, V. (2009). Ilustrowana biochemia Harpera. 28 (P. 588). Nowy Jork: McGraw-Hill.
- Nelson, zm. L., Lehninger, a. L., & Cox, m. M. (2008). Zasady biochemii lehninger. Macmillan.

