Proces izokoryczny
- 1886
- 100
- Arkady Sawicki
Co to jest proces izokoryczny?
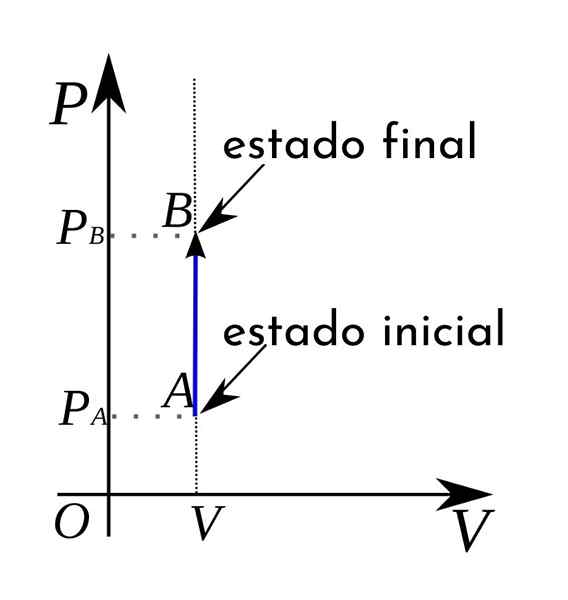
A Proces izokoryczny Jest to każdy proces termodynamiczny, w którym objętość pozostaje stała. Procesy te często otrzymują nazwę izometrycznej lub izovolumetrycznej. Zasadniczo proces termodynamiczny może wystąpić pod stałym ciśnieniem, a następnie nazywany jest izobarycznym.
Kiedy występuje w stałej temperaturze, w takim przypadku mówi się, że jest to proces izotermiczny. Jeśli nie ma wymiany ciepła między systemem a środowiskiem, mówi się o adiabatycznym. Z drugiej strony, gdy istnieje stała objętość, wygenerowany proces nazywa się izokorycznie.

W przypadku procesu izokorycznego można potwierdzić, że w tych procesach praca na objętość ciśnienia jest nieważna, ponieważ wynika to z pomnożenia ciśnienia przez wzrost objętości.
Ponadto na schemacie termodynamicznej objętości ciśnienia procesy izokoryczne są reprezentowane w postaci pionowej linii prostej.
Wzory i obliczenia
Pierwsza zasada termodynamiki
W termodynamice praca jest obliczana na podstawie następującego wyrażenia:
W = p ∙ ∆ v
W tym wyrażeniu W jest pracą mierzoną w dżule, p ciśnienie mierzone w Newton na metr kwadratowy, a ∆ V jest zmianą lub wzrostem objętości mierzonej w metrach sześciennych.
Podobnie, znana jako pierwsza zasada termodynamiki stwierdza, że:
∆ u = q - w
W tej wzorze w systemie wykonanym przez system lub na systemie, czyli ciepło odebrane lub wydane przez system, i ∆ u Jest to wewnętrzna zmienność energii systemu. Przy tej okazji trzy wielkości są mierzone w dżuli.
Ponieważ w procesie izokorycznym praca wynosi zero, okazuje się, że się spełniło:
Może ci służyć: Neptune (planeta)∆ u = qV (Ponieważ ∆ v = 0, a zatem w = 0)
Oznacza to, że wewnętrzna zmienność energii systemu wynika wyłącznie z wymiany ciepła między systemem a środowiskiem. W takim przypadku przeniesione ciepło nazywa się ciepłem do stałej objętości.
 Pojemność cieplna przy stałej objętości
Pojemność cieplna przy stałej objętości
Pojemność cieplna ciała lub systemu wynika z podziału ilości energii w postaci ciepła przeniesionego do ciała lub systemu w danym procesie, a zmiana temperatury doświadczona przez to samo.
Gdy proces jest przeprowadzany przy stałej objętości, mówi się o pojemności cieplnej do stałej objętości i jest oznaczony przez Cv (molowa pojemność cieplna).
W takim przypadku zostanie spełnione:
Qv = N ∙ cv ∙ ∆t
W tej sytuacji n to liczba moli, cv Jest to wyżej wymieniona molowa pojemność cieplna do stałej objętości, a ∆T jest wzrostem temperatury doświadczonej przez korpus lub układ.
Codzienne przykłady procesów izokorycznych
Łatwo jest sobie wyobrazić proces izokoryczny, konieczne jest myślenie o procesie występującym przy stałej objętości; to znaczy, w którym pojemnik zawierający materiał lub system materiału nie zmienia głośności.
Przykładem może być przypadek (idealny) zablokowany w zamkniętym pojemniku, którego objętości nie można zmienić w żadnych środkach dostarczanych ciepło. Załóżmy, że przypadek gazu zablokowanego w butelce.
Przenosząc ciepło do gazu, jak już wyjaśniono, zakończy to wzrost lub wzrost energii wewnętrznej.
Proces odwrotnym byłby gaz gazu zamknięty w pojemniku, którego objętości nie można zmodyfikować. Gdyby gaz ostygnie i daje ciepło do środowiska, wówczas ciśnienie gazu i wartość energii wewnętrznej gazu zmniejszyłaby się.
Może ci służyć: zmienna dyskretna: cechy i przykładyIdealny cykl Otto
Cykl OTTO jest idealnym przypadkiem cyklu używanego przez maszyny benzynowe. Jednak jego początkowe zastosowanie dotyczyło maszyn, które używali gazu ziemnego lub innych paliw w stanie gazowym.
W każdym razie cykl idealny Otto jest interesującym przykładem procesu izokorycznego. Występuje, gdy w wewnętrznym samochodzie spalinowym spalanie benzyny i mieszanki powietrza odbywa się natychmiast.
W takim przypadku ma miejsce wzrost temperatury i ciśnienia gazowego w cylindrze, pozostając stałą objętością.
Praktyczne przykłady
Pierwszy przykład
Biorąc pod uwagę gaz (idealny) zablokowany w cylindrze dostarczonym tłokiem, wskazuj, czy następujące przypadki są przykładami procesów izokorycznych.
- Praca 500 J nad gazem jest zakończona.
W takim przypadku nie byłby to proces izokoryczny, ponieważ wykonywanie pracy na gazie konieczne jest go kompresję, a zatem zmienić jego objętość.
- Gaz rozszerza się poziomo tłok.
Ponownie nie byłby to proces izokoryczny, ponieważ ekspansja gazu implikuje zmienność jego objętości.
- Tłok cylindra jest ustalony, aby nie można było przesuwać gazu, a gaz jest chłodzony.
Przy tej okazji byłby to proces izokoryczny, ponieważ nie będzie zmienności objętościowej.
Drugi przykład
Określić zmianę energii wewnętrznej, która wystąpi gaz zawarty w pojemniku o objętości 10 L Złożony do 1 atm ciśnienia, jeśli jego temperatura wzrośnie z 34 ° C do 60 ° C w procesie izokorycznym, znany jego ciepło molowe ciepła właściwego Cv = 2.5 ·R (istnienie R = 8.31 j/mol · k).
Może ci służyć: Graff Van Generator: Partie, jak to działa, aplikacjePonieważ jest to proces stałej objętości, wewnętrzna zmiana energii wystąpi tylko w wyniku ciepła dostarczonego do gazu. Jest to określone w następującej wzorze:
Qv = N ∙ cv ∙ ∆t
Aby obliczyć dostarczone ciepło, najpierw konieczne jest obliczenie moli gazu zawartych w pojemniku. W tym celu należy uciekać się do równania gazów idealnych:
P ∙ v = n ∙ r ∙ t
W tym równaniu n jest liczba moli, r jest stałą, której wartość wynosi 8,31 j/mol · k, t jest temperaturą, p jest ciśnieniem, do którego gaz mierzony w atmosferze i T jest poddawany, a T jest mierzoną temperaturą W Kelvin.
Jest wyczyszczony i uzyskany:
n = r ∙ t/ (p ∙ v) = 0, 39 moli
Aby:
∆ u = qV = N ∙ cv ∙ ∆T = 0,39 ∙ 2,5 ∙ 8,31 ∙ 26 = 210,65 J

