Podstawy potencjometrii, równania, elektrody

- 5056
- 1248
- Pani Waleria Marek
Potencjometria Jest to technika analizy elektrochemicznej oparta na pomiarze napięcia, pożywki lub przedziału, z którym określono aktywność lub stężenie gatunku (jonowego lub molekularnego). Jest to technika niezniszczająca, ponieważ nie ma na celu modyfikowania chemicznego charakteru danego analitu.
Aby przeprowadzić tę analizę, co najmniej dwie elektrody są niezbędne: jeden odniesienie i inny wskaźnik lub praca. Podobnie, musi istnieć wysoki woltomierz impedancji, z którym napięcia są mierzone bez dopuszczalnego przepływu elektronów między dwiema elektrodami i otaczającymi je roztworami.
 Ogólna reprezentacja niezbędnych elementów do analizy potencjometrycznej. Źródło: Gabriel Bolívar.
Ogólna reprezentacja niezbędnych elementów do analizy potencjometrycznej. Źródło: Gabriel Bolívar. Powyżej mamy ogólną reprezentację montażu do analizy potencjometrycznej. W przedziale, w którym wprowadzana jest elektroda wskaźnikowa, jest gatunek, którego stężenie chcemy ustalić; Podczas elektrody referencyjnej mamy inne rozwiązanie, w którym znamy stężenia jego składników.
Zarejestrowane odczyt napięcia jest zasadniczo należne gatunku zainteresowanego zbliżającego się do elektrody wskaźnikowej. Przy tym napięciu obliczamy stężenie tego gatunku, na przykład stężenie jonów CA2+, Ag+, H+, Na+, K+, Cl-, itp. Potencjometria ma zatem stosowanie chemii klinicznej, środowiskowej, analitycznej i fizykochemicznej.
[TOC]
Podstawy
Napięcie określone w analizach potencjometrycznych to napięcie komórki ikomórka, co jest różnicą między napięciami spowodowanymi przez dwie elektrody, wskaźnik i odniesienie. Elektrody są wrażliwe na aktywność otaczających ich cząsteczek lub jonów, będąc w stanie zaakceptować ich elektrony lub wręcz przeciwnie.
Dwa przedziały są podłączone, więc elektroda elektrody przepływa tam, gdzie następuje redukcja (katoda), do elektrody, w której odbywa się utlenianie (anoda) (anoda).
Jednak to przeniesienie elektronów (lub prądu) jest prawie zerowe, ponieważ w przeciwnym razie reakcje redoks ewoluowałyby, aby całkowicie zmodyfikować stężenia i tożsamości zaangażowanych gatunków.
Może ci służyć: bromek wodoru (HBR)Zamiast tego woltometr ledwo pozwala na przejście elektronów, aby istniało stabilne odczyt napięcia i że komórka może osiągnąć równowagę termodynamiczną.
Mówi się zatem, że potencjometria jest techniką niestatrującej, ponieważ niewiele jonów lub cząsteczek przekształca się w proces pomiaru, który jest również odwracalny.
Główne równania
Potencjał komórkowy
Potencjał komórki jest związany z aktywnością lub stężeniami gatunku zainteresowania poprzez równanie Nernst:
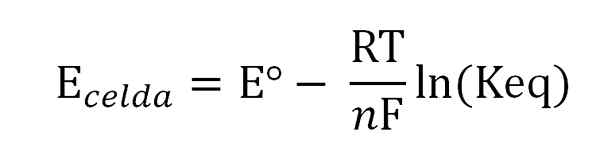 Równanie Nernst. Źródło: Gabriel Bolívar.
Równanie Nernst. Źródło: Gabriel Bolívar. Gdzie Eº jest potencjałem tej samej komórki w standardowych warunkach, f stała Faradaya, N Liczba przeniesionych elektronów, r stała gazu i keq stała bilansu globalnej reakcji. Obliczenia są wykonywane przez wyczyszczenie KEQ z odczytu Ekomórka, i obliczenie pożądanego stężenia wyrażenia równowagi.
Jednak wygodne jest obliczenie stężeń za pomocą łatwiejszej trasy. Zgodnie z konwencją potencjał komórki jest również podawany przez następujące równanie:
Ikomórka = Esiatka- Iwół
Gdzie esiatka Jest to potencjał do półproduktu redukcji, w którym znajduje się elektroda wskaźnikowa; podczas gdy ewół Jest to potencjał do półalicznego utleniania, gdzie mamy elektrodę odniesienia. Zatem równanie można przepisać jako:
Ikomórka = Ewskaźnik - Iodniesienie + IJ
Bycie eJ równe potencjałowi spowodowanemu przez wspólne połączenia mostowe. W praktyce iJ Nie można go ustalić, ale upewnij się, że jego wartość jest tak minimalna, jak to możliwe, przy użyciu bardzo rozcieńczonych roztworów lub upewnienia się, że kompozycje w obu przedziałach są podobne.
Potencjał analitu
Z poprzedniego równania możemy obliczyć iwskaźnik, który jest potencjałem, który naprawdę nas interesuje. Z tą wartością ponownie stosujemy równanie Nernst:
Może ci służyć: acetonitryl (C2H3N)Iwskaźnik = Eº - (RT/NF) LN (czerwony/wołu)
Sieć jest zmniejszoną postacią analitu lub gatunku interesującego, a wołu jest jego utlenioną postacią. Zakładając, że analit jest kationami Zn2+ Na metalicznej elektrodzie cynkowej mielibyśmy:
Iwskaźnik = EºZn2+/Zn - (RT/NF) LN (1/DoZn2+)
Gdzie DoZn2+ Jest to aktywność kationowa Zn2+, które według regulacji eksperymentalnych jest dość zbliżone do jego stężenia [Zn2+]. Z tego równania stężenie Zn jest wyczyszczone2+, że jak widać, bezpośrednio wpływa na wartość Ewskaźnik.
Zmniejszona forma cynku, Zn, przedstawia aktywność równą 1. Dlatego ogólne równanie dla zardzewiałego kationów metalu, który działa jako elektroda, będzie równe:
Iwskaźnik = EºMn+/m - (RT/NF) LN (1/DoM+N)
Ale ma to zastosowanie tylko w przypadku elektrod pierwszych gatunków.
Elektrody
Elektrody, oprócz woltomierza, są najważniejszymi elementami każdej analizy potencjometrycznej. Niektóre z nich zostaną wymienione poniżej.
Pierwszy gatunek
Pierwsze elektrody gatunkowe to metale, które utleniają się w celu powodowania kationów, prowadząc elektrony do woltomierza. Niektóre z nich są następujące: Ag, Zn, Cu, Hg, Sn, TL, CD i BI.
Nie wszystkie metale służą jako elektrody pierwszej klasy, ponieważ nie powinny one przedstawiać krystalicznych nieprawidłowości ani powierzchni pokrytych warstwami tlenku, które powodują niestabilne napięcia.
Drugi gatunek
Z drugiej strony elektrody drugiego gatunku są również metaliczne, ale także zawierają sól na ich powierzchni, której rozpuszczalność zależy od reakcji redoks, które mają miejsce. Na przykład elektrody AG-AGCL i HG-HG2Cl2 (Calomel), to elektrody drugiego gatunku.
Jony selektywne
Selektywne elektrody jonowe, znane również jako membrany, to te wrażliwe na określoną jon lub cząsteczkę, która prześladuje membranę zaprojektowaną tylko dla niego, a nie inne gatunki w roztworze.
Może ci służyć: ograniczający i nadmierny odczynnikUlubionym przykładem tego typu elektrody jest szkło, zbudowane w celu ustalenia stężenia jonów H3ALBO+ lub h+, I w ten sposób służą jako pehometr.
Zastosowania potencjometrii
Chemia środowiska
Potencjometria została wykorzystana w chemii środowiska w określaniu jonów CN-, F- i nie3-, a także amoniak w prądach wodnych.
Chemia kliniczna
Elektrody selektywne są bardzo przydatne, gdy media pomiarowe są złożone. Dlatego pozostałe jony lub cząsteczki będą zakłócać odczyty.
Ta cecha jest szczególnie korzystna w oznaczeniach potencjometrycznych przeprowadzonych w tych samych komórkach, w których wstrzyknięto mikroelektrody w celu określenia stężeń K K+, Na+, Cl-, AC2+ lub h+.
Stopnie potencjometryczne
Załóżmy, że pośrodku, w którym mamy elektrodę wskaźnika, dodaje się tytuł, który reaguje z analitem, a zatem modyfikuje jego stężenie. Wtedy nastąpi zmiany w Ekomórka, który będzie odpowiadał w ten sam sposób zmianę pH w miareczkowaniu kwasowo-zasadowym.
Zatem wykresy ikomórka vs. VTitulant, Możemy określić punkt zwrotny lub równoważność, a dzięki temu znamy stężenie analitu.
Stopnie potencjometryczne są szeroko stosowane w laboratoriach analitycznych i fizykochemicznych. Niektóre anality, które można ustalić za pomocą tej techniki, są następującymi: wiara2+, HCO3-, AC2+, Mg2+, Cu2+, Kwas askorbinowy, między innymi HaLuros.
W pewnym stopniu wszystkie stopnie mogą być przestrzegane przez potencjometryczne zamiast uciekać się do wskaźników i ich końcowych punktów.
Bibliografia
- Dzień, r., & Underwood, a. (1986). Ilościowa chemia analityczna (Ed.). Pearson Prentice Hall.
- Skoog d.DO., West d.M. (1986). Analiza instrumentalna. (Drugi wyd.). Inter -American., Meksyk.
- Dr. Doug Stewart. (2020). Definicja potencjometrii. Odzyskane z: Chemicool.com
- Harvey David. (5 czerwca 2019). Metody potntiometryczne. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Britannica Encyclopaedia. (2020). Elektrograwimetria. Odzyskane z: Britannica.com
- Wikipedia. (2020). Metody elektroanalityczne. Źródło: w:.Wikipedia.org

