Obsługa elektrody Calomel, charakterystyka, wykorzystuje

- 3573
- 954
- Pani Gilbert Stolarczyk
On Elektroda Calomel o Calomelanes to elektroda wtórna, która pozwala określić potencjały pół -life, dzięki reakcji występującej między rtęcią a chlorkiem rtęci (I), Hg2Cl2, wcześniej znany jako Calomel. Zarówno odczynniki, HG i HG2Cl2, Wygrywają lub tracą elektrony w zależności od medium, w którym zanurzona jest elektroda.
Zwykle skrócona jako EC, elektroda ta zastępuje wiele pomiarów standardowej elektrody wodorowej (SHE), ponieważ łatwiej jest ją zbudować i mniej ryzykowne (pomimo rtęci). Wewnątrz zawiera roztwór KCL jako medium elektrolityczne do przepływu elektronów.
 Elektroda calomel w pełnym pomiarze. Źródło: Chandrajit Karmakar, CC BY-SA 4.0, Via Wikimedia Commons
Elektroda calomel w pełnym pomiarze. Źródło: Chandrajit Karmakar, CC BY-SA 4.0, Via Wikimedia Commons Elektroda calomel może mieć różne warianty w zależności od jej wielkości lub ważniejszych, stężenia KCl. Kiedy roztwór KCL jest nasycony, mówimy o elektro z Saturado Calomel (ESC). ESC jest łatwiejsze do przygotowania niż EC, ale bardziej wrażliwy na zmiany temperatury.
Zastosowanie tej elektrody pozwoliło na określenie potencjałów pół -życie dla niezliczonych reakcji redoks. Jest to również powtarzające się urządzenie w kanałach potencjometrycznych, które starają się poznać ilość analitu w zależności od potencjału komórkowego i mierzonego.
[TOC]
Funkcjonowanie
Tak, że elektroda Calomel działała, para HG-HG2Cl2 Musisz zareagować, czy to wygraną, czy tracąc elektrony.
Katod
Kiedy zmniejszenie lub wzmocnienie elektronów występuje wewnątrz elektrody kalomelowej, mamy następujące reakcje:
Hg2Cl2 → Hg22+ + 2cl- (Jonizacja)
Hg22+ + 2e- → 2Hg (redukcja)
Hg2Cl2 + 2e- → 2Hg +2cl- (Reakcja netto)
Może ci służyć: reakcja egzotermicznaDlatego HG2Cl2 Wygraj elektrony zmniejszające się do metalowej rtęci.
Potencjał e elektrody, gdy nastąpi redukcja, jest podana przez równanie:
E = eº - 0.0591 Log [Cl-]
Gdzie obserwuje się, że zależy to wyłącznie od stężenia jonów CL-, jest standardowym potencjałem redukcji tej zmierzonej elektrody przed standardową elektrodą wodoru.
Anodowy
W ramach elektrody może również wystąpić proces utleniania:
2HG → HG22+ + 2e- (Utlenianie)
Hg22+ + 2cl- → Hg2Cl2 (Opad atmosferyczny)
2HG +2Cl- → Hg2Cl2 + 2e- (Reakcja netto)
To znaczy, że rtęć utlenia się, aby wygenerować więcej Hg2Cl2.
Potencjał e w tym przypadku jest podany przez:
E = eº + 0.0591 Log [Cl-]
I znowu, a to zależy od [Cl-].
Reakcja ogólna
Ogólna reakcja na elektrodę Calomela wynosi:
Hg2Cl2(s) + 2e- ⇌ 2Hg (l) + 2cl-
Poczucie bilansu będzie zależeć od medium, w którym elektroda jest w kontakcie. Cl- Określić rozpuszczalność HG2Cl2, który z kolei ma wpływ na tworzenie lub utlenianie HG.
Oraz potencjał określony dla określonego stężenia jonów CL- Będzie to równe:
ICalomel = Esiatka - Iwół
Bycie eCalomel Potencjał zgłaszany jako odniesienie w niektórych potencjalnych tabelach.
Charakterystyka elektrody Calomel
Reprezentacja pół
Półprzepusta Elektrody Calomel może być reprezentowana w następujący sposób:
Pt | HG | Hg2Cl2|. Cl- (Xm)
Gdzie ważne jest tylko stężenie jonów CL-, wyrażone w molowości lub normalności. Potencjał e elektrody będzie się różnić, jeśli zostanie wypełniona roztworami o różnych stężeniach KCl.
Na przykład EC z KCl 0.1 m ma i równe 0.3356 V w 25 ° C; Podczas gdy ESC, z nasyconym KCl, ma jeden i równy 0.2444 V w tej samej temperaturze.
Może ci służyć: Isopentano: Struktura, właściwości, użycia, uzyskanieDlatego stężenie KCl jest najważniejszą cechą elektrod kalomelowych, ponieważ wskazuje, czego użyć, gdy wykonywane zostaną obliczenia pomiarów potencjometrycznych.
W handlu osiągnięto trzy typy elektrod kalomelowych: nasycone (ESC), dziewiętnaste (0.1 n lub 0.1 m kcl) i normalne (1 n lub 1 m kcl). Elektroda Calomel 1 M KCl byłaby reprezentowana jako:
Pt | HG | Hg2Cl2|. Cl- (1 m)
Imprezy
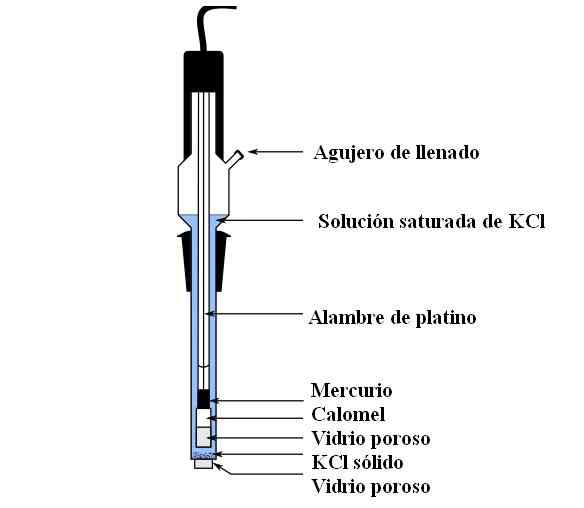 Części elektrody Calomel. Źródło: Bachi-Bouzou, CC0, Via Wikimedia Commons
Części elektrody Calomel. Źródło: Bachi-Bouzou, CC0, Via Wikimedia Commons Na górnym obrazie pokazujemy główne części zwykłej elektrody kalomelowej. Jest wykonany z szkła i składa się z dwóch pojemników: zewnętrznego, który jest umieszczony w kontakcie elektrochemicznym z medium pomiarów i zawiera roztwór KCL; I wewnętrzny, w którym spoczywa mieszanka HG-HG2Cl2.
Wewnętrznie elektroda Calomel zawiera ciekłą rtęć, na której przylegana jest paste HG2Cl2 zwilżone rtęcią. To jest najbardziej aktywna faza elektrody. Porowate szkło służy, aby umożliwić tylko wejście lub wyjście z jonów CL-, Ale nie kryształy HG2Cl2 lub krople rtęci.
Kabel platynowy, w którym przepływ elektrony są zanurzone w rtęci i jest odpowiedzialny za podłączenie elektrody z danym obwodem i obwodem zewnętrznym.
Przez otwór napełniający wylewa się roztwór KCl, który zawiera rozpuszczone rozdzielki soli. Tymczasem na dole elektrody mamy bardzo mały otwór w porowatym szkle, który wchodzi w bezpośredni kontakt z medium pomiarów. Celem porowatego szkła jest umożliwienie kontaktu bez niepożądanych wymiany substancji, które zanieczyszczają elektrodę lub próbkę.
Może ci służyć: cyklohexen: struktura, właściwości, synteza i zastosowaniaZalety
Elektroda Calomel przedstawia następujące zalety w odniesieniu do standardowej elektrody wodorowej:
-Łatwy w budowie i manipulowaniu
-Jego potencjał komórkowy pozostaje stały, nawet jeśli woda odparowuje
-Nie potrzebujesz mostu solnego
ESC jest najłatwiejszy do zbudowania z elektrod kalomelowych, ponieważ KCl wystarczy, aby rozpuścić się, dopóki ich kryształy nie zostaną utworzone. Wtedy roztwór będzie nasycony i gotowy do zrzucania w elektrodzie.
Niedogodności
Jednak elektroda Calomela przedstawia następujące wady:
-Zawierając ciekłą rtęć, może to wywierać negatywny wpływ na środowisko
-Nie można go wykorzystać do analiz ilościowych w próbkach o temperaturze większej niż 60 ° C, ponieważ Hg2Cl2 zaczyna się rozpadać, powodując awarię odczytów elektrod
ESC ma również wadę, że jest bardzo wrażliwy na zmiany temperatury.
Srebrna elektroda srebrna zastąpiła Calomel w wielu oznaczeniach potencjometrycznych.
Aplikacje
Elektroda Calomela jest jedną z wielu elektrod, które są codziennie używane w ustalaniach potencjometrycznych, pozwalając na uzyskanie potencjałów pół -life.
Również elektroda calomel jest używana w pomiarach pH i cyklicznej woltometrii.
Bibliografia
- Dzień, r., & Underwood, a. (1986). Ilościowa chemia analityczna (Ed.). Pearson Prentice Hall.
- Wikipedia. (2020). Nasycona elektroda kalomelowa. Źródło: w:.Wikipedia.org
- Generalic, Eni. (20 października 2018 r.). Elektroda Calomel. Chemia chemii chorwacko-chemii słownik i glosariusz. KTF-SPLIT. 30 października. 2020. Odzyskany z: Glosariusz.Periodni.com
- Skoog d.DO., West d.M. (1986). Analiza instrumentalna. (Drugi wyd.). Inter -American., Meksyk.
- Hills, g., Ives, d. T. (1950). Elektroda Calomel. Natura 165, 530 doi.Org/10.1038/165530a0
- JMGAV. (9 grudnia 2012 r.). Potencjometria (ii): elektrody. Źródło: Triplenlace.com
- « Charakterystyka paradygmatu społeczno -krytycznego, metody, przedstawiciele
- Podstawy potencjometrii, równania, elektrody »

