Zdegenerowane orbitale

- 2643
- 256
- Eugenia Czapla
 Schemat energetyczny z orbitali zajmowanymi przez brakujące elektron. Źródło: Gabriel Bolívar
Schemat energetyczny z orbitali zajmowanymi przez brakujące elektron. Źródło: Gabriel Bolívar Zdegenerowane orbitale Są to te znalezione na tym samym poziomie energii. Zgodnie z tą definicją muszą mieć ten sam główny numer kwantowy N. Zatem orbitale 2s i 2p są zdegenerowane, ponieważ należą do poziomu energii 2, chociaż wiadomo, że ich funkcje fal kątowych i promieniowych są różne.
Jako wartości N, Elektrony zaczynają zajmować inne poziomy energii, takie jak orbitale D i F.
Każdy z tych orbitali ma swoje własne cechy, które na pierwszy rzut oka obserwuje się w ich postaciach kątowych; Są to figurki sferyczne, hantli (p), liści koniczyny (d) i kuliste (f).
Wśród nich istnieje różnica energii, nawet należąca do tego samego poziomu N.
Na przykład schemat energii z orbitali zajmowanymi przez brakujące elektrony (nieprawidłowy przypadek) pokazano na górnym obrazie (nieprawidłowy przypadek).
Można zauważyć, że najbardziej stabilna (najmniej energii) jest Orbital NS (1s, 2s, ...), podczas gdy NF jest najbardziej niestabilny (ten z największą energią).
Zdegenerowane orbitale izolowanego atomu
Zdegenerowane orbitale o tej samej wartości co N, Są w tej samej linii w schemacie energii.
Z tego powodu trzy czerwone paski symbolizujące orbitale p znajdują się w tej samej linii; jak w ten sam sposób rób fioletowe i żółte paski.
Schemat obrazu narusza zasadę zlewu: orbitale o większej energii są wypełnione elektronami.
Może ci służyć: kwasy i zasady: różnice, cechy, przykładyKiedy elektrony łączą się, orbital traci energię i wywiera większą odpychanie elektrostatyczne na brakujące elektrony innych orbitali.
Jednak takie efekty nie są brane pod uwagę na wielu schematach energii. Jeśli tak, i przestrzeganie zasady zlewu bez całkowitego wypełniania orbitali d, okaże się, że przestają być zdegenerowani.
Jak wspomniano powyżej, każdy orbital ma swoje własne cechy. Izolowany atom z konfiguracją elektroniczną jest chętny do elektronów w dokładnej liczbie orbitali, które pozwalają im hostować.
Tylko osoby energii można uznać za zdegenerowane.
Orbitale str
Trzy czerwone paski orbitali obrazu obrazu wskazują, że oba pX, PI I pz Mają tę samą energię.
W każdym z nich zniknęło elektron, opisany przez cztery liczby kwantowe (N, L, Ml I SM), podczas gdy pierwsze trzy opisują orbitale.
Jedyna różnica między nimi jest oznaczona przez moment magnetyczny Ml, który rysuje trajektorię PX Na osi x, pI na osi y i pz na osi Z.
Te trzy są takie same, ale różnią się tylko swoimi orientacjami przestrzennymi. Z tego powodu zawsze są narysowani energią, to znaczy degeneruj.
Podobnie jak w tym samym atomie azotu (konfiguracja 1S22s22 p3) Musisz zachować zwyrodnienie trzech orbitali. Jednak scenariusz energii zmienia się nagle, jeśli jest uważany za atom N w cząsteczce chemicznej lub związku.
To tak, ponieważ chociaż pX, PI I pz Są takie same pod względem energii, co może się różnić w każdym z nich, jeśli mają różne środowiska chemiczne; to znaczy, jeśli są one powiązane z różnymi atomami.
Może ci służyć: Isopreno: Struktura, właściwości, aplikacjeOrbitale d
Pięć fioletowych pasków oznacza orbitale d. W izolowanym atomie, nawet jeśli sparowali elektrony, uważa się, że te pięć orbitali jest zdegenerowane. Jednak w przeciwieństwie do orbitali P, tym razem istnieje wyraźna różnica w ich formach kątowych.
Dlatego ich elektrony przemieszczają kierunki w przestrzeni, które różnią się w zależności od orbity D do drugiego.
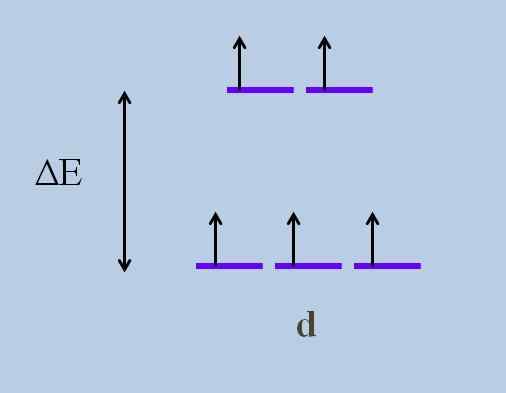
To powoduje, zgodnie z Krystaliczna teoria pola, że minimalne zakłócenia powoduje Rozkładanie energii orbitali; Oznacza to, że pięć fioletowych pasków oddzielają między nimi szczelinę energii:
 Schemat rozwijania energii orbitali. Źródło: Gabriel Bolívar
Schemat rozwijania energii orbitali. Źródło: Gabriel Bolívar Jakie są orbitale powyżej i które są poniżej? Te powyżej są symbolizowane jako IG, i te poniżej T2 g.
Zwróć uwagę, jak początkowo wszystkie fioletowe paski zostały wyrównane, a teraz utworzono zestaw dwóch orbitali IG więcej energii niż drugi zestaw trzech orbitali T2 g.
Teoria ta pozwala wyjaśnić przejścia D-D, na które przyznaje się wiele kolorów obserwowanych w związkach metali przejściowych (Cr, Mn, Faith itp.).
To zaburzenia elektroniczne wynika z interakcji koordynacyjnych środka metalu z innymi nazywanymi cząsteczkami Ligand.
Orbitale f
A w przypadku orbitali F, siedem żółtych pasków, sytuacja jest dodatkowo skomplikowana. Jego adresy przestrzenne różnią się znacznie między nimi, a wizualizacja ich linków staje się zbyt złożona.
W rzeczywistości uważa się, że orbitale f są takiej warstwy wewnętrznej, że nie „uczestniczą w znacznym stopniu” w tworzeniu linków.
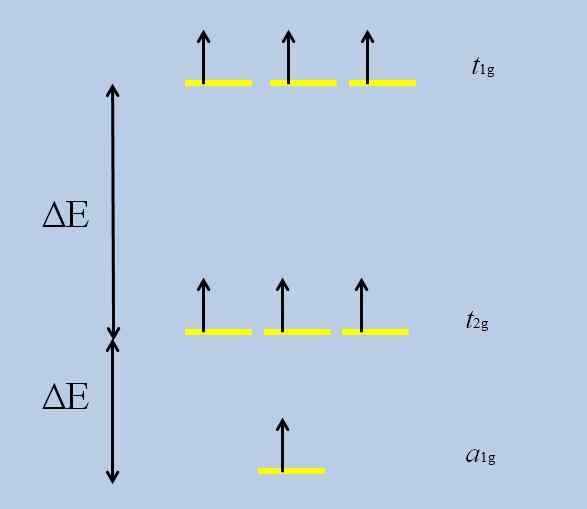
Może ci służyć: tlenek nadchlorowy (CL2O7)Gdy atom izolowany z orbitali F jest otoczony innymi atomami, rozpoczyna się interakcje i następuje rozkładanie (utrata zwyrodnienia):
 Schemat utraty degeneracji. Źródło: Gabriel Bolívar
Schemat utraty degeneracji. Źródło: Gabriel Bolívar Zauważ, że teraz żółte paski tworzą trzy zestawy: T1G, T2 g I Do1G, I nie są już zdegenerowani.
Zdegeneowane hybrydowe orbitale
Widziano, że orbitale mogą się rozwijać i tracić zwyrodnienie. Jednak chociaż wyjaśnia to przejścia elektroniczne, nie wyjaśnia, w jaki sposób i dlaczego istnieją różne geometrie molekularne. Tutaj wchodzą orbitale hybrydowe.
Jego główną cechą jest to, że są one zdegenerowane. W ten sposób wynikają one z mieszanki znaków orbitalnych S, P, D i F, aby spowodować zdegenerowane hybrydy.
Na przykład trzy orbitale P są mieszane z jednym S, aby dać cztery orbitale SP3. Wszystkie orbitale SP3 Są zdegenerowane i dlatego mają tę samą energię.
Jeśli dodatkowo dwa orbitale są zmieszane z czterema SP3, Zostanie uzyskanych sześciu orbitali3D2.
I jak wyjaśniają geometrie molekularne? Ponieważ istnieje sześć, z równymi energią, muszą być one w konsekwencji kierowane symetrycznie w przestrzeni, aby wygenerować równe środowiska chemiczne (na przykład w związku MF6).
Kiedy to robią, powstaje oktaedron koordynacji, który jest równy geometrii oktaedrycznej wokół centrum (M).
Jednak geometrie zwykle wykazują zniekształcenia, co oznacza, że nawet hybrydowe orbitale nie są całkowicie zdegenerowane.
Dlatego, jako wniosek, zdegenerowane orbitale istnieją tylko w izolowanych atomach lub wysoce symetrycznych środowiskach.
Bibliografia
- Definicja Degerate. Odzyskane z: Chemicool.com
- Atomy i orbitale atomowe. Odzyskane z Sparknotes.com
- Whitten, Davis, Peck i Stanley. Chemia. (8.ª ed.). Cengage Learning.

