Numer masowy, z czego składa się i jak go zdobyć (z przykładami)
- 2982
- 437
- Marianna Czarnecki
On Liczba masowa o Masowa liczba atomu jest sumą liczby protonów i ilości neutronów jądra. Cząstki te są oznaczone zamiennie z nazwą Nukleony, Dlatego numer masowy reprezentuje ich ilość.
Niech n liczba neutronów obecna i z liczba protonów, jeśli nazywamy to, jak numer masowy, to:
A = n + z
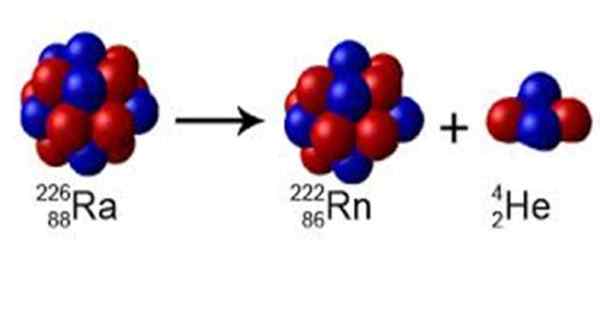
 Rysunek 1. Radio ma numer masy a = 226, rozpada się na radon z a = 222 i emituje rdzeń helu a = 4. Źródło: Wikimedia Commons. Perox [CC0] [TOC]
Rysunek 1. Radio ma numer masy a = 226, rozpada się na radon z a = 222 i emituje rdzeń helu a = 4. Źródło: Wikimedia Commons. Perox [CC0] [TOC]
Przykłady numerów masowych
Natychmiast niektóre przykłady liczb mas dla dobrze znanych elementów:
Wodór
Najbardziej stabilny i obfity atom wodoru jest również najprostszy: 1 proton i elektron. Ponieważ rdzeń wodoru nie ma neutronów, prawdą jest, że a = z = 1.
Tlen
Rdzeń tlenu ma 8 neutronów i 8 protonów, a zatem a = 16.
Węgiel
Życie na Ziemi opiera się na chemii węgla, atomie lekkim z 6 protonami w jądrze plus 6 neutronów, jako A = 6 + 6 = 12.
Uran
Ten ciężki element niż poprzednie, jest dobrze znany ze swoich właściwości radioaktywnych. Rdzeń uranu ma 92 protony i 146 neutronów. Następnie twój numer masowy wynosi A = 92 + 146 = 238.
Jak zdobyć numer masowy?
Jak powiedziano wcześniej, liczba masy A elementu zawsze odpowiada sumie liczby protonów i liczbie neutronów zawierających jego jądro. Jest to również liczba całkowita, ale ... czy istnieje jakakolwiek reguła pod względem związku między obiema ilościami?
Zobaczmy: wszystkie wymienione powyżej elementy są lekkie, z wyjątkiem uranu. Atom wodoru jest, jak powiedzieliśmy, najprostszy. Nie ma neutronów, przynajmniej w najliczniejszej wersji, a w tlenu i węgla istnieje równa liczba protonów i neutronów.
Może ci służyć: co to jest wycieranie emisji? (Z przykładami)Dzieje się to również w przypadku innych elementów światła, takich jak azot, kolejny bardzo ważny gaz na całe życie, który ma 7 protonów i 7 neutronów. Ponieważ jednak jądro jest bardziej złożone, a atomy stają się cięższe, liczba neutronów rośnie wraz z innym rytmem.
W przeciwieństwie do elementów światła, uran, z 92 protonami, ma około 1 ½ razy więcej niż w neutronach: 1 ½ x 92 = 1.5 x 92 = 138.
Jak widać, jest to dość blisko 146, ilość neutronów.
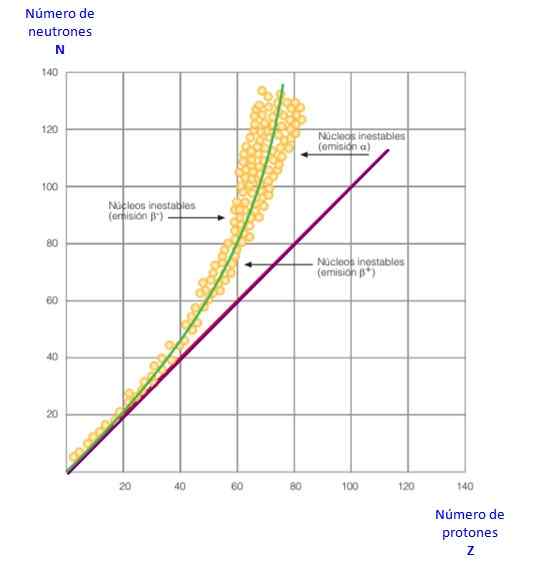 Rysunek 2. Krzywa stabilności. Źródło: f. Zapata.
Rysunek 2. Krzywa stabilności. Źródło: f. Zapata. Wszystko to staje się widoczne w krzywej na rycinie 2. Jest to wykres n w porównaniu do z, znany jako krzywa stabilności jądrowej. Tam można zobaczyć, w jaki sposób atomy światła mają taką samą liczbę protonów jak neutron i jak z Z = 20 rośnie liczba neutronów.
W ten sposób duży atom staje się bardziej stabilny, ponieważ nadmiar neutronów zmniejsza odpychanie elektrostatyczne między protonami.
Notacja dla atomów
Bardzo przydatne notacja, która szybko opisuje rodzaj atomu, jest następujący: symbol elementu i odpowiednie liczby atomowe i masowe są zapisane, jak pokazano poniżej w tym schemacie:
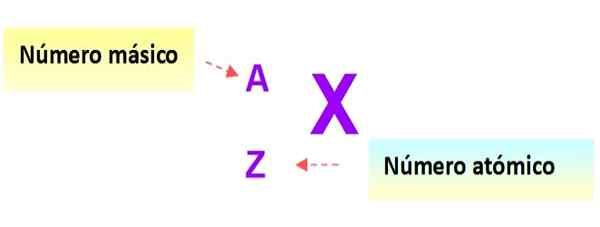 Rysunek 3. Notacja atomowa. Źródło: f. Zapata.
Rysunek 3. Notacja atomowa. Źródło: f. Zapata. W tej notacji atomy poprzednich przykładów byłyby:

Czasami używana jest kolejna bardziej wygodna notacja, w której używany jest tylko symbol elementu i numeru masowego, aby oznaczyć atom, pomijając liczbę atomową. W ten sposób 12 6C jest napisane po prostu jako Carbon-12, 16 8Lub byłby to tlen-16 i tak dla każdego elementu.
Może ci służyć: półkole: jak obliczyć obwód, obszar, centroid, ćwiczeniaIzotopy
Liczba protonów w jądrze określa naturę elementu. Na przykład każdy atom, którego jądro zawiera 29 protonów, jest atomem miedzianym, cokolwiek się stanie.
Załóżmy, że atom miedzi traci elektron z jakiegokolwiek powodu, ale wciąż jest miedzi. Jednak teraz jest to jonizowany atom.
Jądro atomowe trudniej jest wygrywać lub stracić proton, ale w naturze może się zdarzyć. Na przykład wewnątrz gwiazd są stale tworzone cięższe elementy z elementów światła, ponieważ jądro gwiazdy zachowuje się jak reaktor fuzyjny.
I tutaj na ziemi jest zjawisko Rozłączenie radioaktywne, w którym niektóre niestabilne atomy wydalają nukleony i emitują energię, przekształcając się w inne elementy.
Wreszcie istnieje możliwość, że atom określonego elementu ma inny numer masy, w tym przypadku jest to izotop.
Dobrym przykładem jest znany Carbon-14 lub Radiokarbon, który jest używany do datowania przedmiotów archeologicznych i jako biochemiczny znacznik. To ten sam węgiel o identycznych właściwościach chemicznych, ale z dwoma dodatkowymi neutronami.
Carbon-14 jest mniej obfity niż węgiel-12, stabilny izotop, a także radioaktywny. Oznacza to, że z czasem rozpada się przez emitując energię i cząstki, aż stanie się stabilnym elementem, który w jego przypadku jest azot.
Izotopy węglowe
Węgiel istnieje w naturze jako mieszanka kilku izotopów, z których najliczniejsza jest wyżej wymieniona 12 6C lub Carbon-12. A oprócz Carbon-14 jest 13 6C z dodatkowym neutronem.
Może ci służyć: Obwody bieżące naprzemienne: typy, aplikacje, przykładyJest to powszechne w naturze, na przykład cyny, znane jest 10 stabilnych izotopów. Z drugiej strony pojedynczy izotop jest znany jako beryl i sód.
Każdy izotop, naturalny lub sztuczny, ma inny rytm transformacji. W ten sam sposób można stworzyć sztuczne izotopy w laboratorium, które są zwykle niestabilne i rozpadają się radiowo w bardzo krótkim okresie drugiej frakcji, podczas gdy inne biorą znacznie więcej, jak wiek ziemi lub więcej.
Naturalny stół izotopowy węglowy
| Izotopy węglowe | Numer atomowy z | Numer masowy a | Obfitość % |
|---|---|---|---|
| 12 6 C | 6 | 12 | 98.89 |
| 13 6 C | 6 | 13 | 1.jedenaście |
| 14 6 C | 6 | 14 | Ślady |
Rozwiązane przykłady
- Przykład 1
Jaka jest różnica pomiędzy 13 7 N i 14 7 N?
Odpowiedź
Oba są atomami azotu, ponieważ ich liczba atomowa wynosi 7. Jednak jeden z izotopów, który ma a = 13, ma mniej neutronów, podczas gdy 14 7 N jest najliczniejszym izotopem.
- Przykład 2
Ile neutronów jest w jądrze atomu rtęciowego, oznaczonego jako 201 80 Hg?
Odpowiedź
Ponieważ A = 201 i Z = 80, a także wiedząc::
A = z + n
N = a - z = 201 - 80 = 121
I stwierdzono, że atom rtęci ma 121 neutronów.
Bibliografia
- Connor, n. Co to jest nukleon - struktura jądra atomowego - definicja. Pobrano z: okresowe opłatę.org.
- Knight, r. 2017. Fizyka dla naukowców i inżynierii: podejście strategiczne. osoba.
- Sears, Zemansky. 2016. Fizyka uniwersytecka z nowoczesną fizyką. 14. Wyd. Głośność 2.
- Tippens, s. 1. 2011. Fizyka: koncepcje i zastosowania. 7. edycja. McGraw Hill.
- Wikipedia. Liczba masowa. Źródło: w:.Wikipedia.org.
- « Azotan magnezu (Mg (NO3) 2) Struktura, właściwości, wykorzystuje
- Coplanares Punkty równania, przykładowe i rozstrzygnięte ćwiczenia »

