Modele atomowe
- 4588
- 176
- Pani Waleria Marek
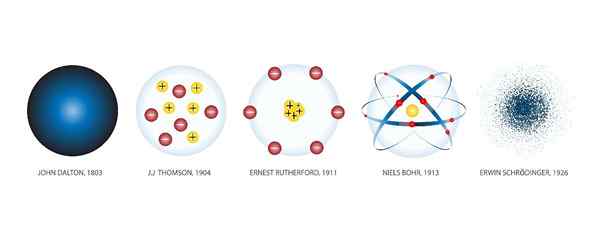
 Modele atomowe to różne reprezentacje graficzne, które zostały przekazane atomom w całej historii. Shuttersock
Modele atomowe to różne reprezentacje graficzne, które zostały przekazane atomom w całej historii. Shuttersock Jakie są modele atomowe?
Modele atomowe Są to graficzne reprezentacje struktury i działania atomu. W całej historii było wiele modeli.
Wynika to z faktu, że idea atomu jako podstawowego bloku, której powstaje materia, narodził się tysiące lat temu, w starożytnej Grecji. W tym czasie atom był tylko produktem filozoficznych spekulacji.
Ponieważ dokonano nowych odkryć naukowych, powstały nowe modele w celu uwzględnienia uzyskanej wiedzy. I tak się stało po stuleciu do dziś, kiedy technologia pozwoliła nam obserwować atomy za pomocą mikroskopów i określić prawidłowy model.
Co to są atomy?
Atomy są podmiotoskopijnymi strukturami, o których powstaje cały temat, który postrzegamy, i z którymi codziennie wchodzimy w interakcje, z własnego ciała, jedzenia, które nosimy, po duże wieżowce i samoloty.
Również słońce, księżyc, planety, gwiazdy i galaktyki są tworzone z atomami.
Są tak małe, że nie można ich zaobserwować za pomocą wspólnych mikroskopów. Inne są wymagane z większej władzy, zwane ultramikroskopami. Jednak atomy nie są najmniejszymi jednostkami natury.
Atomy powstają z kolei przez jeszcze mniejsze cząstki: protony, neutrony i elektrony.
Protony mają dodatni ładunek elektryczny, podczas gdy neutrony nie mają żadnego ładunku elektrycznego. Te dwa typy cząstek tworzą jądro atomu.
Obracając się wokół jądra, jak planety wokół słońca, to elektrony, które mają ujemny ładunek elektryczny.
Model atomowy Demokrytusa

Demokryt Abdery był greckim filozofem, który mieszkał między 460 a 370 przed obecną epoką. Potwierdził, że cała materia została utworzona przez małe cząstki, które nazywał atomami, co w grecku oznacza niepodzielne.
Według Demokrytusa atom jest najmniejszą częścią, w której sprawa można podzielić. Istnieje ich nieskończona liczba, które są niezniszczalne, niesamowite, wieczne i absolutnie zwarte, bez porów. Istnieje kilka rodzajów, które różnią się w zależności od formy, wielkości, pozycji i sposobu, w jaki są gotowi.
Może ci służyć: katastrofy spowodowane przez człowieka podczas korzystania z nauki i technologiiTeoria Demokryta została odrzucona przez Arystotelesa, a następnie całkowicie zapomniana, aż do pojawienia się współczesnej nauki.
Model atomowy Dalton

John Dalton (1766-1844) był angielskim meteorologiem zainteresowanym badaniem przepisów regulujących zachowanie gazowe. Owoc jego pracy w tej dziedzinie był pierwszym atomowym modelem współczesnej nauki, którą zrobił w 1803 roku.
Ponieważ istnienie protonów i elektronów nie zostało jeszcze odkryte, Dalton powiedział, podobnie jak Demokrits, że atom jest najmniejszą częścią, w której materia może być podzielona, a zatem sama w sobie jest niepodzielna.
Według Daltona atomy są solidne i mają sferyczny kształt, jak piłka baseballowa. Dalton zilustrował swoją rzeźbę teorii w drewnie, wraz z jego asystentami, dziesiątki sfer, które reprezentowały atomy różnych pierwiastków chemicznych.
Ten model obowiązuje do czasu odkrycia elektronu.
Model atomowy Thomsona
Angielski fizyk Joseph John Thomson (1865–1940) musiał dokonać jednego z najważniejszych odkryć współczesnej nauki: electron.
To było w 1897 r. W Cavendish Laboratory University of Cambridge w Anglii, gdzie tablica wciąż upamiętnia wielkie odkrycie.
Thompson i jego asystenci projektują promienie katodowe na polu elektrycznym. Po kontakcie z polem promienie odchylały się tworząc szerokie kąty. To potwierdziło, że promienie katodowe miały ujemny ładunek elektryczny. Te ujemnie naładowane cząstki nazywały je elektrony.
Thomson założył, że elektrony zostały osadzone w atomach. Jego model atomowy pochodzi z 1904 roku.
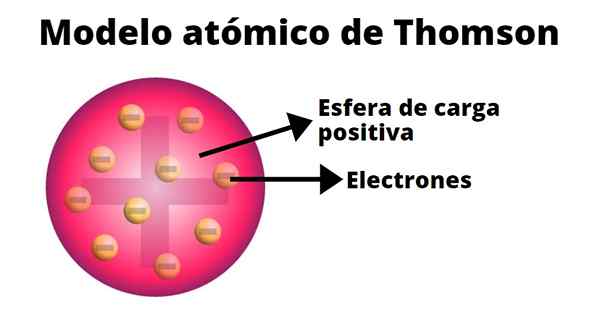
Budyń rodzynek
W modelu atomowym Thompsona atom jest stałą kulą o obciążeniu dodatnim (protony), na którym neutrony (obciążenie ujemne) są losowo rozmieszczone, ponieważ rodzynki wyrzucane na pudin. Właśnie dlatego ten model był znany jako „Pudin de Pasas”.
Według Thompsona atom ma promień 0,00000001 centymetrów, a jego obciążenie jest neutralne, ponieważ protony i elektrony mają takie samo obciążenie, ale ze znakiem przeciwnym.
Model Thompsona nie przedstawia neutronów.
Rutherford Atomic Model
Ernest Rutherford (1871–1937), fizyk neozyański, był jednym z najwybitniejszych studentów Thomsona.
Może ci służyć: badania korelacyjneW 1911 r. I na podstawie niedawnego odkrycia radioaktywności, Rutherford przeprowadził następujący eksperyment: wystrzelili alfa radioaktywne cząstki o dużej prędkości i energii na arkuszu złota.
Jeśli model atomowy Thompsona był prawidłowy, cząstki alfa przechodzą przez arkusz bez odchylenia lub z nieistotnym odchyleniem. Jednak kiedy obliczyli kąt odchylenia od cząstek, odkryli, że był szeroki, i że niektórzy nawet podskakują do złotego arkusza.
Z tym wynikiem Rutherford zrozumiał, że atom powinien mieć bardzo mały i wysoce skondensowany rdzeń. To jądro zostało dodatnie naładowane.
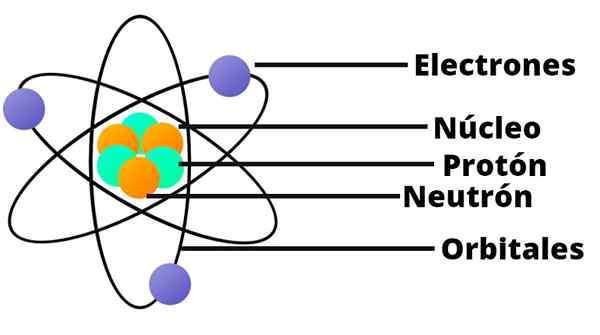
Mały układ słoneczny
Model atomowy Rutherforda jest jak miniaturowy układ słoneczny. W centrum, w miejscu, które odpowiadałoby słońcu, istnieje rdzeń z jego pozytywnie załadowanymi protonami. Wokół tego, orbitując jako planety, są losowo rozłożone elektrony.
Rutherford ustalił również, że masa atomu jest równoważna sumie mas elektronów i protonów.
Model atomowy Bohr
Chociaż model Rutherford był niezaprzeczalnym postępem w odniesieniu do poprzednich modeli, miał ważne wady. Na przykład, jeśli elektrony skutecznie orbitalne wokół jądra ostatecznie straciłyby energię i zapadną się na jądro. Ale to oczywiście się nie stało.
To duński fizyk Niels Bohr (1885–1962), student Rutherford na University of Manchester (Anglia), który zaproponowałby w 1913 r. Model atomowy, który rozwiązał problemy jego starego profesora.
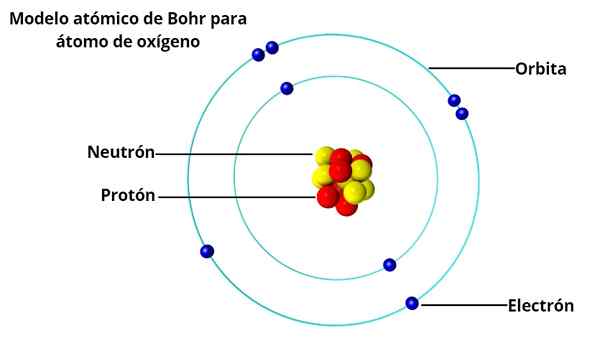
Okrągłe orbity
W modelu atomowym BOHR elektrony nie orbitują swobodnie wokół jądra, ale robią to w stabilnych orbitach kołowych, oddzielonych od siebie pewną odległością, podobnie jak ułożone planety układu słonecznego. Każda orbita nazywa się poziomem energii lub energii.
Na podstawie badań Maxa Plancka i Alberta Einsteina ustalił, że każdy elektron na ich orbicie ma pewną ilość energii.
Podczas kroku stabilnego wokół jądra, mówi się, że elektrony są w stanie stacjonarnym. Z drugiej strony, gdy elektron „skacze” na orbitę o niższej energii, jest foton.
Może ci służyć: MetodologiaJednak model Bohr nie był skuteczny w wyjaśnieniu działania atomów z więcej niż jednym elektronem.
Model atomowy Sommerfeld
Arnold Sommerfeld (1868–1951) był niemieckim fizykiem, który poświęcił swoją pracę na rozszerzenie modelu atomowego Bohra. Ten rozszerzony model został przedstawiony w 1916 roku.
W oparciu o teorię względności Einsteina Sommerfeld odkrył, że niektóre elektrony krążą wokół jądra przy prędkościach w pobliżu światła (300.000 kilometrów na sekundę).
Dokonał także następujących modyfikacji modelu Bohr:
- Elektrony poruszają się wokół jądra w orbitach okrągłych i eliptycznych. Bohr rozpoznał tylko okrągłe orbity.
- W tym samym poziomie energii znajdują się podpokomle z nieco innymi energią.
Model mechaniczny kwantowy (Broglie, Heisenberg i Schrödinger)
Jest to najdokładniejszy model atomowy, który jest znany i jest obecnie akceptowany, a niektóre kolejne dodatki. Został opracowany przez trzech naukowców: niemiecki Werner Heisenberg (1901–1976), austriacki Erwin Schrödinger (1887–1961) i Francuz Louis de Broglie (1892-1987).
Ten model odrzuca ideę elektronów, które orbitują jądro. Zamiast tego mamy chmury elektroniczne, które są przestrzeniami wokół jądra, w których można znaleźć elektron. To zachowuje się jak fala stacjonarna.
Prawdopodobieństwo jego znalezienia jest obliczane za pomocą równania ustalonego przez Schrödingera.
Jest to kwantowy model mechaniczny atomu, który rozpoczął się od równania Schrödingera. Przy tym równaniu możesz znać prawdopodobieństwo znalezienia elektronu w pewnym punkcie atomu.
W tym modelu każdy elektron porusza się w określonym kierunku, który jest określany przez cztery liczby kwantowe, które są: główna liczba kwantowa, wtórna liczba kwantowa, magnetyczna liczba kwantowa i liczba kwantowa spin.
Nie ma dwóch elektronów, które mają identyczne liczby kwantowe, jak stwierdzono w zasadzie wykluczenia odkrytego przez fizyk Wolfgang Pauli.
Bibliografia
- (2010). Atom. Nowoczesne encyklopedia British.
- (S. F.). Model atomowy demokryta, filozoficzny atomizm. Zaczerpnięte z energii nuklearnej.internet.
- (S. F.). Model atomowy Sommerfeld, rozszerzenie do modelu Bohr. Zaczerpnięte z energii nuklearnej.internet.
- Bertsch, g. F.; Trefil, James i McGrayne, Sharon Bertsch (2021). Atom. Britannica Encyclopedia. Zaczerpnięte z Britannica.com.
- Duignan, ur. (2021). Demokryt. Britannica Encyclopedia. Zaczerpnięte z Britannica.com.
- Współtwórcy Encyklopedii Nowego Świata. (2021). Atom. Zaczerpnięte z Newworldyclopedia.org.
- Zita, Ana. (S. F.). Modele atomowe. Zaczerpnięte z Todamaterii.com.

