Kwas chlorowy (HCL)

- 1995
- 28
- Herbert Wróblewski
 Pojemnik z kwasem solnym. Shuttersock
Pojemnik z kwasem solnym. Shuttersock Co to jest kwas solny?
On kwas chlorowodorowy (HCl) lub kwas muriatinowy, jest związek nieorganiczny, który powstaje przez roztwór w wodzie chlorku wodoru, powodując jon hydroniowy (H (H. H3ALBO+) i jon chlorkowy (CL-). Mówiąc dokładniej, jest to hydracja chloru halogenu z wodorem.
HCl jest silnym kwasem, który jest całkowicie zjonizowany w wodzie, a jego produkty jonizacyjne są stabilne. Całkowita jonizacja HCl jest potwierdzona przez fakt, że pH roztworu HCl 0,1 M wynosi 1.
Główną metodą produkcji przemysłowej HCL jest chlorowanie związków organicznych do produkcji, na przykład, dichlorometanu, trichloroetylenu, perkloroetylenu lub chlorku winylu. HCl jest produktem ubocznym reakcji chlorowania.
Jest stosowany w stopniach podstawowych w licznych reakcjach chemicznych, w trawieniu chemicznym związków organicznych itp.
Opary kwasu chlorowodorowego (chlorek wodoru) mogą powodować poważne zmiany oczu. Mogą również wywoływać podrażnienie i poważne problemy na drogach oddechowych.
Światło żołądka ma kwasowe pH (1-3) o wysokim stężeniu HCl. Obecność kwasu sprzyja sterylizacji zawartości żołądka, inaktywując liczne bakterie obecne w żywności. To wyjaśniałoby zapalenie żołądka i jelit związane ze stanem acroerhydrii.
Ponadto HCL ułatwia trawienie białek poprzez aktywację enzymu pepsyny działania proteolitycznego.
Jest stosowany w czyszczeniu basenów, zwykle wystarczy detergent, ale istnieją plamy między płytkami, wymagające w tych przypadkach zastosowania kwasu solnego.
Jest stosowany w kontroli pH w produktach farmaceutycznych, żywności i wodzie pitnej. Jest również stosowany w neutralizacji przepływów odpadów zawierających materiał alkaliczny.
Kwas solny jest stosowany w regeneracji wymiany jonów, stosowany do porwania jonów metalicznych lub innych rodzajów jonów w branży, w laboratoriach badawczych i oczyszczaniu wody pitnej.
Z drugiej strony można również skomentować, że chlorek wodoru, związek gazowy, jest cząsteczką dwuatomiczną, a atomem, które ją tworzą, łączy wiązanie kowalencyjne. Tymczasem kwas kloohydowy jest związkiem jonowym, który w roztworze wodnym jest zdysocjowany w H+ i Cl-. Interakcja między tymi jonami jest elektrostatyczna.
Struktura chemiczna kwasu solnego
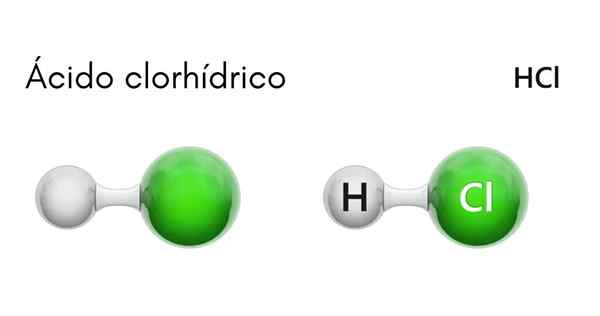
Każda cząsteczka HCl jest tworzona przez atom wodoru i inny chlor. Chociaż w temperaturze pokojowej HCl jest trujący i bezbarwny gaz, jeśli rozpuści się w wodzie, występuje kwas solny.
Tworzenie kwasu chlorowodorowego
-Może być wytwarzany przez elektrolizę NaCl (chlorek sodu), który powoduje H2 (G), cl2 (g), 2nd (ac) i OH- (AC). Następnie:
H2 + Cl2 => 2 HCl
To jest reakcja egzotermiczna.
-HCl występuje przez reakcję chlorku sodu kwasem siarkowym. Proces, który można schematyzować w następujący sposób:
NaCl +h2południowy zachód4 => Nahso4 + HCl
Może ci służyć: kwasowe sole (oksisals)Następnie zbiera się chlorek wodoru i reaguje się chlorek sodu z bisulfitem sodu zgodnie z następującą reakcją:
NaCl +nahso4 => Na2południowy zachód4 + HCl
Ta reakcja została wprowadzona przez Johana Glaubera w XVII wieku w celu wytworzenia kwasu solnego. Jest obecnie stosowany w laboratoriach, ponieważ znaczenie jego użytku przemysłowego spadło.
-Kwas chlorowodorowy można wytwarzać jako produkt uboczny chlorowania związków organicznych, takich jak: w produkcji dichlorometanu.
C2H4 + Cl2 => C2H4Cl2
C2H4Cl2 => C2H3CL +HCl
Ta metoda produkcji HCL jest bardziej stosowana w przemysłowo, obliczając, że 90% HCL wyprodukowanych w Stanach Zjednoczonych jest przez tę metodologię.
-I wreszcie HCl występuje podczas spalania chlorowanych odpadów organicznych:
C4H6Cl2 + 5 o2 => 4 co2 + 2 godz2O +2 HCl
Gdzie jest kwas solny?
Kwas solny jest zatężony w świetle żołądka, w którym osiąga się pH 1. Istnienie bariery śluzowej, bogatej w wodorowęglan, zapobiega uszkodzeniu komórek żołądka z powodu niskiego pH żołądka.
Istnieją trzy główne bodźce fizjologiczne do wydzielania H+ przez komórki ciemieniowe ciała żołądka: gastrina, histamina i acetylocholina.
Gastrina
Gastrina jest hormonem wydzielanym w regionie klubu żołądka, który działa poprzez zwiększenie wewnątrzkomórkowego stężenia CA, pośrednika aktywacji aktywnego transportu H+ w kierunku światła żołądka.
Aktywny transport wykonuje enzym ATPAY, który wykorzystuje energię zawartą w ATP do przenoszenia H+ w kierunku światła żołądka i wprowadzaj k+.
Histamina
Jest wydzielany przez komórki podane SO podobne do enterokromofin (SEC) ciała żołądka. W jego działaniu pośredniczy wzrost stężenia cyklicznego wzmacniacza i działa poprzez zwiększenie, a także gastrina, aktywny transport H+ W kierunku światła żołądka za pośrednictwem pompy H+-K+.
Acetylocholina
Jest wydzielany przez terminale nerwowe błędne, a także średnia gastrina jej działanie dla wzrostu wewnątrzkomórkowego CA, aktywując działanie pompy H+-K+.
H+ komórek ciemieniowych pochodzi z reakcji Co2 z h2Lub formować h2WSPÓŁ3 (kwas węglowy). Jest to następnie podzielone na h+ i HCO3-. H+ Jest aktywnie transportowany do światła żołądka przez błonę wierzchołkową żołądka. Tymczasem HCO3- Jest przeniesiony do krwi połączonej z wejściem Cl-.
Mechanizm zamachu stanu przeciw transakcji lub antitransport-HCO3- która występuje w błonie podstawowej komórek ciemieniowych, wytwarza wewnątrzkomórkową akumulację Cl-. Następnie jon trafi do światła żołądka towarzyszące+. Szacuje się, że wydzielanie żołądka HCl ma stężenie 0,15 m.
Inne biologiczne źródła HCL
Istnieją inne bodźce wydzielania HCL przez komórki ciemieniowe, takie jak kofeina i alkohol.
Wrzód żołądka i dwunastnicy występuje, gdy bariera jest przerywana, która chroni komórki żołądka przed szkodliwym działaniem HCL.
Może ci służyć: siarczek cynkowy (ZNS)Eliminując wyżej wspomniane działanie ochronne, bakterie Helicobacter Pilori, Kwas acetylosalicylowy i niestaroidalne przeciwpramierze (NLPZ) przyczyniają się do produkcji owrzodzeń.
Wydzielanie kwasu działa jako funkcja eliminacja drobnoustrojów obecnych w żywności i inicjuje trawienie białka, poprzez działanie pepsyny. Główne komórki w tajemnicy ciała żołądka.
Właściwości fizyczne i chemiczne kwasu solnego
Waga molekularna
36 458 g/mol.
Kolor
Jest to bezbarwny lub lekko żółtawy płyn.
Zapach
To irytujący zapach akra.
Smak
Próg degustacji w czystej wodzie jest stężenie 1,3 x 10-4 Moles/L.
Punkt wrzenia
-121º F A 760 mmHg. -85,05º C przy 760 mmHg.
Temperatura topnienia
-174º F (-13,7 ° F) dla roztworu HCL 39,7% P/P w wodzie), -114,22º C.
Rozpuszczalność wody
Roztwór HCL może mieć 67% P/P A 86º F; 82,3 g/100 g wody w 0ºC; 67,3 g/100 g wody w 30º C i 63,3 g/100 g wody w 40º C.
Rozpuszczalność metanolu
51,3 g/100 g roztworu w 0º C i 47 g/100 roztworu w 20º C
Rozpuszczalność etanolu
41,0 /100 g roztworu w 20º C
Rozpuszczalność eterowa
24,9 g/100 roztwór w 20º C.
Gęstość
1059 g/ml w 59º F w 10,17 % roztworu P/P.
Gęstość gazu
100045 g/l
Gęstość pary
1 268 (w relacji powietrznej wzięte jako 1)
Ciśnienie pary
32.452 mmHg przy 70ª F; 760 mmHg w temperaturze -120,6 º f
Stabilność
Ma wysoką stabilność termiczną.
Samo -ukierunkowanie
To nie jest łatwopalne.
Rozkład
Rozkłada się przez ogrzewanie, emitując toksyczny dym chloru.
Lepkość: 0,405 CPOise (ciecz w 118,6 ° K), 0,0131 CPOise (pary przy 273,06 ° K).
Korozja
Jest wysoce żrący aluminium, miedzi i stali nierdzewnej. Atakuje wszystkie metale (rtęć, złoto, platyna, srebro, tantalio, z wyjątkiem niektórych stopów).
Napięcie powierzchniowe
23 mn/cm przy 118,6º K.
Polimeryzacja
Aldehydes i epoksydy doświadczają gwałtownej polimeryzacji w obecności kwasu chlorowodorowego.
Na właściwości fizyczne, takie jak lepkość, ciśnienie pary, temperatura wrzenia i temperatura topnienia wpływają procentowe stężenie dla HCL.
Zastosowania kwasu solnego
Kwas solny ma wiele zastosowań w domu, w różnych branżach, w laboratoriach dydaktycznych i badawczych itp.
Przemysł i dom
-Kwas chlorowodorowy stosuje się w przetwarzaniu hydrometalurgicznym, na przykład w produkcji glinu i dwutlenku tytanu. Jest stosowany w aktywacji produkcji studni naftowych.
Wtrysk kwasu zwiększa porowatość wokół oleju, faworyzując w ten sposób jego ekstrakcję.
-Służy do eliminacji złóż kako3 (Węglan wapnia) przez transformację w COCL2 (chlorek wapnia), który jest bardziej rozpuszczalny i łatwy do wyeliminowania. Podobnie jest używany przemysłowo w przetwarzaniu stali, materiału o licznych zastosowaniach i zastosowaniach zarówno w branżach, jak i w konstrukcjach i domu.
-Masy używają rozwiązań HCL do mycia i czyszczenia cegieł. Jest używany w domu w pracy o czyszczeniu i dezynfekcji łazienek i ich odpływów. Ponadto w grawerowaniach stosuje się kwas solny, w tym operacje czyszczenia metali.
Może ci służyć: termiczna: struktura, charakterystyka, formacja, przykłady-Kwas chlorowodorowy jest stosowany w eliminacji tlenku żelaza Mohoso.
Wiara2ALBO3 + Fe +6 HCl => 3 FECL2 + H2ALBO
-Pomimo tego, że jest wysoce żrący, służy do usuwania metalowych plam obecnych w żelazku, miedzi i mosiądzu, stosując rozcieńczenie 1:10 w wodzie.
Synteza i reakcje chemiczne
-Kwas solny jest stosowany w reakcjach podstawowych lub reakcji alkalicznych, a także w roztworze roztworu pH. Ponadto jest stosowany w licznych reakcjach chemicznych, na przykład w trawieniu białka, procedurze przed badaniami zawartości aminokwasów i identyfikacji.
-Głównym zastosowaniem kwasu solnego jest wytwarzanie związków organicznych, takich jak chlorek winylu i dichlorometan. Kwas jest pośrednikiem w produkcji poliwęglanów, węgla aktywnego i kwasu askorbinowego.
-Jest używany w produktach Pegas. Podczas gdy w przemyśle tekstylnym jest używany w wybielaniu tkanin. Jest używany w branży opalania skórzanego interweniującego w przetwarzaniu. Uważa również, że jest stosowany jako nawóz i w produkcji chlorku, barwników itp. Jest również stosowany w galwanoplastyce, w fotografii i w przemyśle gumowym.
-Jest stosowany w produkcji sztucznego jedwabiu, w rafinacji olejów, tłuszczów i mydeł. Ponadto jest stosowany w reakcjach polimeryzacji, izomeryzacji i alkilacji.
Ryzyko i toksyczność kwasu solnego
Ma korozyjne działanie na skórze i błonach śluzowych wytwarzających oparzenia. Te, jeśli są poważne, mogą wytwarzać wrzody, pozostawiając keloid i wysuwane blizny. Kontakt wzrokowy może powodować całkowite zmniejszenie lub utratę wzroku z powodu uszkodzenia rogówki.
Kiedy kwas dociera do twarzy, może powodować poważne blizny, które zniekształcają twarz. Częste kontakt z kwasem może również powodować zapalenie skóry.
Spożycie kwasu solnego powoduje oparzenie jamy ustnej, gardła, przełyku i przewodu pokarmowego, powodując nudności, wymioty i biegunkę. W skrajnych przypadkach może wystąpić perforacja przełyku i jelit, z zatrzymaniem krążenia i śmiercią.
Z drugiej strony opary kwasowe, w zależności od ich stężenia, mogą powodować podrażnienie dróg oddechowych, powodując zapalenie gardła, obrzęk Glottis, zwężenie oskrzeli z zapaleniem oskrzeli, sinicy i obrzęku płuc (nadmierne gromadzenie cieczy w płucach) i w ekstremalnych przypadki, śmierć.
Ekspozycja na wysoki poziom opar.
Martwica zębów, która objawia się w zębach, są również częste wraz z utratą ich jasności; Stają się żółtawo i miękkie, a wreszcie pękają.
Bibliografia
- SuwiousGuy. (2018). Kwas chlorowodorowy (HCL): Ważne zastosowania i zastosowania. Zaczerpnięte z: StudiousGuy.com
- Ganong, w. F. (2003). Przegląd fizjologii medycznej. Dwudziesta pierwsza edycja. McGraw-Hill Companies Inc.
- Ctr. Arkusz bezpieczeństwa kwasu chlorowodorowego. [PDF]. Zaczerpnięte z: uacj.MX

