Struktura metilaminy, właściwości, produkcja, zastosowania
- 2153
- 149
- Marianna Czarnecki
Metilamina Jest to związek organiczny, którego skondensowana formuła to Cho3NH2. W szczególności jest to najprostsza pierwotna alkyamina ze wszystkich, ponieważ zawiera tylko podstawnik alquiliczny, który jest taki sam, jak powiedzenie, że istnieje tylko jeden kowalencyjny łącznik C-N.
W normalnych warunkach jest to gaz amoniak, który pachnie jak ryba, ale jest to stosunkowo łatwe do kondensacji i transportu w hermetycznych zbiornikach. Podobnie można go znacznie rozwiązać w wodzie, powodując żółtawe roztwory. Z drugiej strony można go również transportować jako solidne w postaci soli chlorowodorkowej, CH3NH2· HCl.
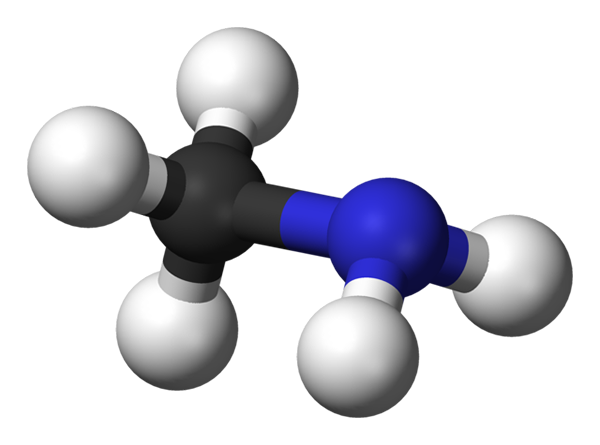
 Cząsteczka metilaminy. Źródło: Benjah-BMM27 przez Wikipedia.
Cząsteczka metilaminy. Źródło: Benjah-BMM27 przez Wikipedia. Metilamina występuje przemysłowo z amoniaku i metanolu, chociaż istnieje wiele innych metod produkcji w skalach laboratoryjnych. Jego gaz jest wysoce wybuchowy, więc każde źródło ciepła bliskie ma potencjał, aby spowodować wielki pożar.
Jest to związek o wysokim popycie komercyjnym, ale jednocześnie przedstawia silne ograniczenia prawne, ponieważ służy jako surowiec dla narkotyków i substancji psychotropowych.
[TOC]
Struktura
Powyższy obraz pokazuje strukturę molekularną metyloaminy reprezentowaną przez model kul i słupków. Czarna kula odpowiada atomowi węgla, niebieskiego atomu azotu i bieli dla atomów wodoru. Jest to zatem mała cząsteczka, w której metan, cho4, Stracić H dla grupy NH2, dając ch3NH2.
Metilamina jest wysoce polarną cząsteczką, ponieważ atom azotu przyciąga elektroniczną gęstość węgla i atomy wodoru. Ma zdolność do tworzenia mostów wodorowych między kompendium jego sił międzycząsteczkowych. Każda cząsteczka CH3NH2 Możesz przekazać lub zaakceptować kolejny most wodorowy (CH3HNH-NH2Ch3).
Może ci służyć: jaka jest teoria zespołu?Jednak jego masa cząsteczkowa jest znacznie niska, oprócz portów CH3 Utrudniają takie mosty wodorowe. W rezultacie metyloamina jest gazem w normalnych warunkach, ale można go skondensować w temperaturze -6 ° C. Podczas krystalizacji robi to po strukturze ortorombowej.
Nieruchomości
Wygląd fizyczny
Kolorowy gaz lub ciecz, ale których wodne roztwory mogą prezentować żółtawe tony.
Zapach
Nieprzyjemne, podobne do mieszanki ryb i amoniaku.
Masa cząsteczkowa
31 058 g/mol
Temperatura topnienia
-93,10 ºC
Punkt wrzenia
Wokół -6 ºC. Dlatego jest to gaz, który może kondensować w niezbyt niskich temperaturach.
Gęstość
656,2 kg/m3 w 25 ° C. Jego opary są 1,1 razy gęste niż powietrze, podczas gdy jego ciecz lub kondensat jest około 0,89 razy mniej gęsty niż woda.
Ciśnienie pary
W temperaturze pokojowej ciśnienie pary zasiężne 3,5 atm.
Moment dipolarny
1,31 d
Rozpuszczalność wody
1.080 g/l w 20 ° C. Jest to gaz, który bardzo dobrze rozpuszcza się w wodzie, ponieważ obie cząsteczki są polarne i związane ze sobą przy ustalaniu mostów wodorowych (CH3Hnh-oh2).
Zasadowość
Metilamina ma stałą podstawową (PKB) z 3,36. Ta wartość wskazuje, że jest to znacznie podstawowa substancja, nawet więcej niż ten sam amoniak, więc rozpuszcza się w wodzie, uwalnia pewną ilość jonów OH- Po zhydrolizie:
Ch3NH2 + H2Lub ⇌ ch3NH3+ + Oh-
Metilamina jest bardziej podstawowa niż amoniak, ponieważ jej atom azotowy ma większą gęstość elektroniczną. To dlatego, że Cho3 Zrobiłem więcej elektronów azotowych niż trzy atomy wodoru w cząsteczce NH3. Mimo to metyilamina jest uważana za słabą bazę przed innymi alkyaminami lub aminami.
Może Ci służyć: typ linku CO2Punkt flash
-10 ° C do zamkniętego kubka, co oznacza, że jest to wysoce łatwopalny i niebezpieczny gaz.
Temperatura samo -kierunkowego
430 ° C
Napięcie powierzchniowe
19,15 mn/m 25 ºC
Rozkład
Gdy oparza, jest termicznie rozkładany w tlenkach węgla i azotu, które tworzą toksyczny dym.
Produkcja
Metilamina może być wytwarzana lub syntetyzowana metodą komercyjną lub przemysłową lub metodami laboratoryjnymi w niższych skalach.
Przemysłowy
Metilamina występuje przemysłowo poprzez reakcję, która ma miejsce między amoniakiem a metanolem na katalitycznym wsparciu żelu współczulnego. Równanie chemiczne dla tej reakcji jest następujące:
Ch3OH + NH3 → CH3NH2 + H2ALBO
W tym procesie można wygenerować inne alkaminy; Jednak metyilamina jest produktem, który denanetycznie wygląda na bardziej uprzywilejowaną.
Laboratorium
Na poziomie laboratoryjnym istnieje kilka metod, które umożliwiają syntetyzację małej metyloaminy. Jednym z nich jest reakcja w silnym podstawowym pożywce, koh, między acetamidem i bromem, podczas którego generowany jest izocjan metylu, CH3NCO, które z kolei jest hydrolizowane, aby stać się metylacją.
Metilamina może być przechowywana jako stała, jeśli zneutralizowana za pomocą kwasu solnego, tak że powstają powstanie soli chlorowodorkowej:
Ch3NH2 + HCl → CH3NH2· HCl
Następnie chlorowodorek metyloaminy, również reprezentowany jako [CH3NH3] Cl, może opierać się na bezpiecznym miejscu do uzyskania roztworu wodnego z rozpuszczonym gazem:
[Ch3NH3] Cl + NaOH → CH3NH2 + NaCl + H2ALBO
Z drugiej strony metyloamina może być również syntetyzowana z heksaminy (CH2)6N4, który jest bezpośrednio zhydrolizowany kwasem solnym:
Może ci służyć: krystalizacja(Ch2)6N4 + HCl + 6 H2O → 4 NH4Cl + 6 ch2ALBO
Kolejnie, chlorek amonu reaguje z gorącym formaldehydem, powodując opary metyilaminowe i kwasu mrówkowego, HCOOH.
Również metyloaminę można uzyskać, zmniejszając nitrometan, CH3NIE2 z metalicznym cynkiem i kwasem solnym.
Aplikacje
 Efedryna jest lekiem, który potrzebuje metyilaminy do produkcji komercyjnej. Źródło: Turkeyphant.
Efedryna jest lekiem, który potrzebuje metyilaminy do produkcji komercyjnej. Źródło: Turkeyphant. Metilamina jest związek, którego zastosowania zwykle generują kontrowersje, ponieważ jest substancją stosowaną w syntezie narkotyków, takiej jak metamfetamina. W rzeczywistości jego popularność wynika z pożądania, że bohaterowie serialu Breaking Bad Television musieli zdobyć za wszelką cenę.
Związek ten jest również stosowany jako surowiec do produkcji środków owadobójczych, leków, środków powierzchniowo czynnych, materiałów wybuchowych, barwników, fungicydów, dodatków itp., Ma więc silne światowe zapotrzebowanie, oprócz wielu ograniczeń prawnych dla jego przejęcia.
Jego ogromna wszechstronność chemiczna wynika z jej cząsteczki Cho3NH2 Jest to dobry środek nukleofilowy, połączony lub skoordynowany z substratami o większej masie cząsteczkowej w kilku reakcjach organicznych. Na przykład opiera się to na syntezie efedryny, w której Cho3NH2 Dołącza do cząsteczki z konsekwencją utraty h.
Bibliografia
- Morrison, r. T. i Boyd, R, N. (1987). Chemia organiczna. 5. edycja. Redakcja Addison-Wesley Inter-American.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. (10. edycja.). Wiley Plus.
- Wikipedia. (2020). Metyloamina. Źródło: w:.Wikipedia.org
- National Center for Biotechnology Information. (2020). Metyloamina. Baza danych Pubchem., CID = 6329. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Dylan Matthews. (15 sierpnia 2013). Oto, co „Breaking Bad” robi właściwe i złe, o branży metamfetrowej. Odzyskane z: WashingtonPost.com
- PrepChem. (2020). Przygotowanie chlorowodorku metyloaminy. Odzyskany z: PrepChem.com
- « Właściwości nitrylowe, nomenklatura, zastosowania, przykłady
- Polityczna organizacja Azteków władzy »

