Właściwości nitrylowe, nomenklatura, zastosowania, przykłady

- 4519
- 203
- Arkady Sawicki
Nitryle Są to wszystkie te związki organiczne, które mają grupę funkcjonalną CN, która jest również nazywana grupą cyjano lub cyjankiem pod względem chemii nieorganicznej. Alifatyczne azotki są reprezentowane z ogólnym wzorem RCN, podczas gdy aromatyczne nitryle z wzorem ARCN.
Chociaż cyjanek wodoru, HCN, a także sole w metalu cyjanku są wysoce toksycznymi związkami, dokładnie to samo nie zdarza się w przypadku nitryny. Grupa CN w jakimkolwiek szkielecie węglowym (rozgałęziona, liniowa, aromatyczna itp.), zachowuje się po przekątnej różni się od anionu cyjanku, CN-.
 Ogólny wzór dla alifatycznego nitrylu. Źródło: Benjah-BMM27 przez Wikipedia.
Ogólny wzór dla alifatycznego nitrylu. Źródło: Benjah-BMM27 przez Wikipedia. Nitryle są bardzo rozpowszechniane w świecie tworzyw sztucznych, ponieważ kilka z nich wywodzi się z akrylonitrylu, CH2CHCN, nitryl, z którym syntetyzowane są polimery, takie jak gumki nitrylowe, używane do dokonywania operacji lub rękawiczek laboratoryjnych. Nitrile są również obecne w wielu produktach naturalnych i farmaceutycznych.
Z drugiej strony nitryle są prekursorami kwasów karboksylowych, ponieważ ich hydroliza stanowi alternatywną metodę syntezy w celu uzyskania tej ostatniej.
[TOC]
Charakterystyka i właściwości
Struktura
Struktury molekularne nitryny różnią się w zależności od tożsamości R lub AR odpowiednio w związkach RCN lub ARCN.
Jednak geometria grupy CN jest liniowa ze względu na jego potrójne łącze, C≡N, który jest produktem hybrydyzacji SP. Zatem atomy C-C≡N znajdują się w tej samej linii. Poza tymi atomami może istnieć jakakolwiek struktura.
Biegunowość
Nitryle to związki polarne, ponieważ azot grupy CN jest bardzo elektroonegatywna i przyciąga do siebie elektrony. Dlatego mają punkty fuzji lub gotowania wyżej niż ich homologowie.
Może ci służyć: Scandio: History, właściwości, reakcje, ryzyko i zastosowaniaNa przykład acetonitryl, cho3CN, jest to ciecz, która gotuje się w temperaturze 82 ° C; Podczas gdy Etano, CH3Ch3, Jest to gaz, który gotuje się w temperaturze -89 ° C. Zwróć uwagę na wielki wpływ, jaki grupa CN ma na interakcje międzycząsteczkowe.
To samo rozumowanie dotyczy większych związków: jeśli mają jedną lub więcej grup CN w swojej strukturze, jest całkiem prawdopodobne, że ich biegunowość wzrośnie i będzie bardziej związana z powierzchniami lub cieczami polarnymi.
Zasadowość
Można by pomyśleć, że z powodu wysokiej biegunowości nitryl, są to stosunkowo silne podstawy przed aminami. Musimy jednak wziąć pod uwagę wiązania kowalencyjne C≡N oraz fakt, że zarówno węgiel, jak i wodór mają hybrydyzację SP.
Zasadność RCN: jest reprezentowana przez przyjmowanie protonu z wody: woda:
Rcn: + h2Lub ⇌ rcnh+ + Oh-
Aby protonować rcn: moment obrotowy bez elektronu azotu musi tworzyć powiązanie z jonem h+. Ale istnieje niedogodność: hybrydyzacja azotu sprawia, że jest zbyt elektroonigatywna, tak bardzo, że ta para elektronów jest bardzo silnie przyciągana i nawet nie pozwala na tworzenie wiązania.
Dlatego mówi się, że para azotu azotu azotu nie jest dostępna i że zasadowość nitryl jest bardzo niska. W rzeczywistości nitryle są miliony razy mniej podstawowe niż aminy.
Reaktywność
Wśród najbardziej reprezentatywnych reakcji nitryli mamy ich hydrolizę i redukcję. W tej hydrolizy pośredniczy kwasowość lub zasadowość środowiska wodnego, powodując odpowiednio kwas karboksylowy lub sól karboksylanową:
Może ci służyć: równowaga płynówRCN + 2H2O + HCl → RCOOH + NH4Cl
RCN + H2O + NaOH → Rcona + NH3
W tym procesie powstaje również amida.
Nitrile są redukowane do amin przy użyciu katalizatorów wodoru i metali:
RCN → RCH2NH2
Nomenklatura
Według nomenklatury IUPAC nitryle są wymieniane przez dodanie sufiks -nitrile do nazwy łańcucha alkan. Zatem Cho3CN nazywa się Ethanonitilo i Cho3Ch2Ch2CN, Butanonitryl.
Można je również wyznaczyć z nazwy kwasu karboksylowego, który jest wyeliminowany przez słowo „kwas”, a sufiksy są zastąpione -Oic lub -oico przez sufiks -onitryl. Na przykład dla CH3CN byłby acetonitrylem (kwas octowy); Dla c6H5CN, byłby to benzonitryl (kwasu benzoesowego); i dla niego (Cho3)2CHCN, 2-metylopropanitrilu.
Alternatywnie, jeśli rozpatrzone są nazwy podstawników alquilian, nitryle można wymienić za pomocą słowa „cyjanku”. Na przykład Cho3CN byłby następnie nazywany cyjankiem metylu i (cho3)2CHCN, izopropylowe cyjanki.
Aplikacje
Nitrile są częścią naturalnych produktów, będąc w gorzkich migdałach, w kościach różnych owoców, u zwierząt morskich, roślin i bakterii.
Jego grupy CN tworzą struktury cyjanogennych lipidów i glikozydów, biomolekuł, które po zdegradowaniu uwalniania cyjanku wodoru, HCN, wysoce trującego gazu. Dlatego mają zbliżające się biologiczne zastosowanie niektórych stworzeń.
Wcześniej powiedziano, że grupy CN nadają cząsteczkom dużo polaryzacji, a w rzeczywistości nie stają się niezauważone, gdy są obecne w związkach z aktywnością farmakologiczną. Takie leki nitrylowe zastosowano do zwalczania hiperglikemii, raka piersi, cukrzycy, psychozy, depresji i innych zaburzeń.
Może ci służyć: nieodwracalna reakcja: cechy i przykładyOprócz roli w biologii i medycynie, przemysłowo tworzą garść nitrylowych tworzyw sztucznych, z którymi wytwarzane są rękawiczki chirurgiczne i laboratoryjne, znaczki części samochodowych, węży i stawów ze względu na ich oporność na korozję i tłuszcze, materiały takie jak materiały, takie jak materiały, takie jak materiały, takie jak materiały, takie jak materiały, takie jak materiały, takie jak materiały Tupperware, instrumenty muzyczne lub bloki Legos.
Przykłady nitrylowe
Następnie i na koniec zostaną wymienione przykłady nitryl.
Gumki nitrylowe
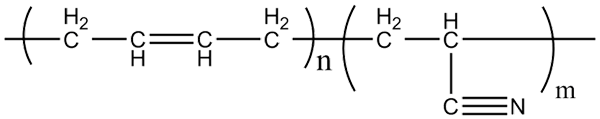 Struktura molekularna kopolimerów akrylonitrylowych-butadienów. Źródło: Klever przez Wikipedia.
Struktura molekularna kopolimerów akrylonitrylowych-butadienów. Źródło: Klever przez Wikipedia. Guma nitrylowa, z którą wytwarzane są wspomniane rękawiczki i materiały oporne na tłuszcz, jest kopolimerem utworzonym przez akrylonitryl i butadien (powyżej). Zwróć uwagę, jak liniowa wygląda grupa CN.
Ciamemazine
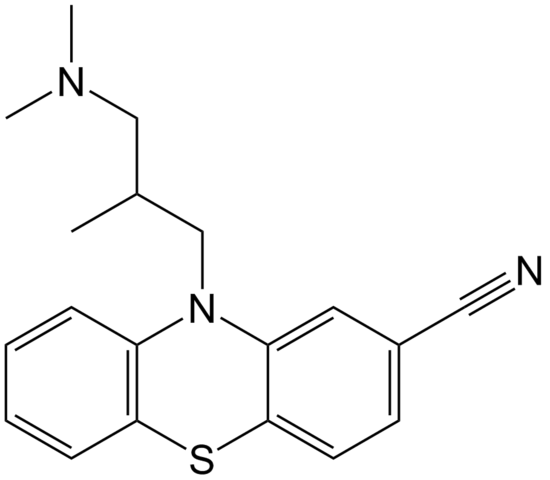 Struktura molekularna cypemazyny. Źródło: domena epop / pub
Struktura molekularna cypemazyny. Źródło: domena epop / pub Cyammazina jest przykładem nitrylu w obszarze aptecznym, który jest stosowany jako leki przeciwpsychotyczne, szczególnie w leczeniu zaburzeń lękowych i schizofrenii. Ponownie zwróć uwagę na liniowość grupy CN.
Citalopram
 Innym lekiem nitrylowym jest citalopram, stosowany jako leki przeciwdepresyjne
Innym lekiem nitrylowym jest citalopram, stosowany jako leki przeciwdepresyjne Amygdalina
 Struktura molekularna migdałkowej. Źródło: Wesalius / Public Domena
Struktura molekularna migdałkowej. Źródło: Wesalius / Public Domena Migdałek jest przykładem cyjanogenicznego glucóside. Znajduje się w gorzkich migdałach, śliwkach, morelach i brzoskwiń. Zwróć uwagę, jak mała wygląda grupa CN w odniesieniu do reszty struktury; Mimo to jego pojedyncza obecność jest wystarczająca, aby zapewnić unikalną tożsamość chemiczną tym węglowodanem.
Bibliografia
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. (10th Wydanie.). Wiley Plus.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Morrison i Boyd. (1987). Chemia organiczna. (Piąta edycja). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Nitryl. Źródło: w:.Wikipedia.org
- Chemia librettexts. (5 czerwca 2019). Chemia nitryl. Odzyskane z: chem.Librettexts.org
- Jim Clark. (2016). Hydrolizowanie nitryle. Odzyskane z: chemguide.współ.Wielka Brytania
- Ivy Rose Holistic. (2020). Nazwa nitrylowe. Źródło: Ivyrose.com
- Germán Fernández. (S.F.). Nomenklatura nitrylowa: Reguły IUPAC. Odzyskane z: Chemicicaorganica.org
- « 8 głównych prądów psychologicznych i ich autorów
- Struktura metilaminy, właściwości, produkcja, zastosowania »

