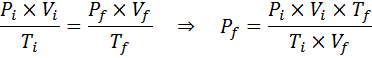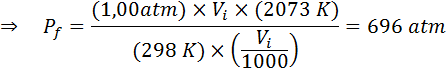Prawo gazów ogólnych

- 2090
- 26
- Marianna Czarnecki
Jakie jest ogólne prawo gazowe?
Prawo gazów ogólnych, Czasami nazywane również połączonym prawem gazów, jest to połączenie praw Boyle'a, Charlesa i Gay-Lussaca. Jest to prawo opisujące związek między ciśnieniem, temperaturą i objętością stałej ilości gazu idealnego.
Oświadczenie tego prawa mówi:
„Jeśli liczba moli gazu jest stała, związek między objętością ciśnienia a produktem temperatury pozostaje stała."
W formie matematycznej ogólne prawo gazów wyraża się w następujący sposób:
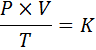
Gdzie p reprezentuje ciśnienie gazu, v jego objętość, jego temperatura bezwzględna, a K jest stałą proporcjonalności, której wartość zależy zarówno od ilości obecnego gazu, jak i jednostek, w których wyrażane są inne zmienne.
Alternatywne formy ogólnego prawa gazowego
Jako prawo proporcjonalności
Alternatywny sposób wyróżnienia ogólnego prawa gazów jest postać prawa proporcjonalności:
„Dla każdej stałej ilości gazu iloczyn jego ciśnienia i objętości jest wprost proporcjonalny do temperatury”.
To znaczy że:
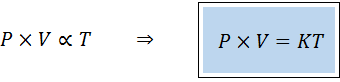
Jest to równoważne z pomnożeniem obu członków pierwszego równania według temperatury.
Związek między stanem początkowym i końcowym
Podobnie jak prawa Boyle, Charles i Gay-Lussac, ogólne prawo gazowe można wyrazić jako związek między państwem początkowym a końcowym stanem gazu, który ulega zmianie państwa.
W przeciwieństwie do poprzednich przepisów, nie jest konieczne, aby żadna z trzech zmiennych nie pozostała stała, tylko liczba moli. To znaczy, że stosunek PXV/T będzie taki sam w stanie początkowym, Siema, i w ostatecznym stanie, F. Innymi słowy, ogólne prawo gazowe można również wyrazić matematycznie jako:
Może ci służyć: kwas panie: co to jest, struktura, synteza, właściwości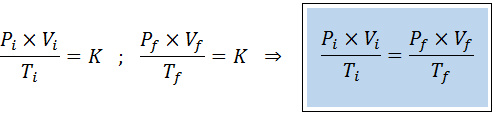
Wyprowadzenie wzoru ogólnego prawa gazowego
Jak wspomniano powyżej, ogólne prawo gazowe pochodzi z kombinacji praw Boyle'a, Charlesa i Gay-Lussaca. Przepisy te przedstawiono poniżej:
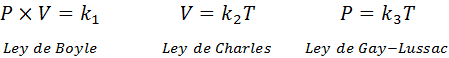
Jeśli z każdego z tych praw wyświetlamy stałą k, A potem mnożymy je ze sobą, otrzymujemy:
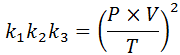
Teraz, biorąc pierwiastek kwadratowy u obu członków, ogólne prawo gazowe uzyskuje się:
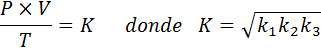
Ogólne prawo gazów vs. Prawo gazów idealnych
Nie należy się mylić prawa gazów ogólnych z prawem gazów idealnych. Pomimo tego, że jest dwoma bardzo podobnymi, a także ściśle powiązanymi prawami, ogólne prawo gazowe łączy tylko prawa Boyle, Charlesa i Gay-Lussaca.
Ze swojej strony prawo gazów idealnych dodaje zasadę Avogadro, zgodnie z którą ”Równe objętości różnych gazów mierzonych w tych samych warunkach temperatury i ciśnienia zawierają tę samą liczbę cząstek ”.
W konsekwencji, oprócz powiązania temperatury, objętości i ciśnienia, prawo gazu idealnego pozwala również na powiązanie z liczbą cząstek lub moli gazu, więc reprezentuje równanie stanu statusu Gazy idealne.
W poniższych równaniach różnicę między tymi dwoma prawami można łatwiej zaobserwować:

Zauważ, że główną różnicą między obiema prawem jest to, że idealne prawo Gase obejmuje N, który reprezentuje liczbę moli, a także zamiast stałej K, ma Stała R, która jest stałą idealnych gazów.
Może ci służyć: terpenosMożna powiedzieć, że prawo gazów idealnych jest bardziej ogólne niż ogólne prawo gazowe, ponieważ można je zastosować dla dowolnej ilości gazu pod dowolnym zestawem ciśnienia, temperatury i objętości. Z drugiej strony zastosowanie ogólnego prawa gazu wymaga, aby ilość gazu pozostała stała.
Przykłady zastosowania ogólnego prawa gazowego
Poniżej znajdują się przykłady typowych problemów, w których można zastosować ogólne prawo gazowe:
Przykład 1: Podwodna bańka powietrza
Załóżmy, że nurka na głębokości 20 m pod wodą, gdzie ciśnienie wynosi 3,00 atm, a temperatura 15 ° C uwalnia oddech powietrza, a jedna z bąbelków ma początkową objętość 100 cm3.
Określ objętość pęcherzyka powietrza, gdy dotrze do powierzchni, która znajduje się w standardowych warunkach temperatury i ciśnienia, zakładając, że ilość powietrza wewnątrz pęcherza nie zmienia się w miarę wzrostu.
Rozwiązanie
Najpierw musimy wyodrębnić wszystkie dane z instrukcji. Rozumie się, że istnieją dwa różne stany dla gazu, jeden początkowy i jeden koniec, więc oddzielamy dane na dwie grupy. Konieczne jest również przekształcenie temperatur w temperaturze bezwzględnej:

Ponieważ problem określa, że nie ma zmiany w ilości gazu (powietrza), możemy zastosować ogólne prawo gazowe, z którego możemy wyczyścić ostateczny objętość:
Może ci służyć: Rodio: Historia, właściwości, struktura, zastosowania, ryzyko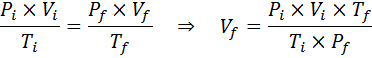
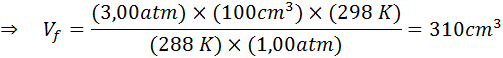
Dlatego bąbelek powietrza osiąga objętość 310 cm3 Po dotarciu na powierzchnię.
Przykład 2: Wysokie ciśnienie
Ile ciśnienia gazu idealnego, która jest w temperaturze otoczenia 25 ° C i ciśnienie 1,00 atm i spręż się tysiąc jego objętości?
Rozwiązanie
Tak jak poprzednio, zaczynamy od wyodrębnienia danych:

Jak mówi, że proces jest przeprowadzany w zamkniętym pojemniku, wówczas ilość gazu się nie zmienia, więc można zastosować ogólne prawo gazowe: