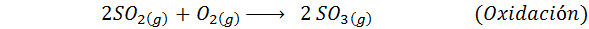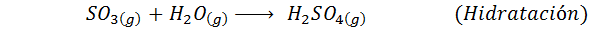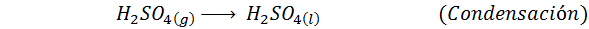Kwas siarkowy (H2SO4)

- 2895
- 775
- Filip Augustyn
Wyjaśniamy, jaki kwas siarkowy, jego struktura chemiczna, właściwości, jak się jego uzyskuje, zastosowania i ryzyko użytkowania
 Łodzie kwasu siarkowego (H2SO4)
Łodzie kwasu siarkowego (H2SO4) Co to jest kwas siarkowy?
On Kwas Siarkowy, Nazywany również siarczanem wodorowym i olejem witriolu, jest to kwas siarki do oksykcji utworzony przez reakcję bezwodnika siarkowego (więc3) i woda. Jego wzór molekularny to h2południowy zachód4 I jest to zdecydowanie najczęściej wytwarzany i używany kwas mineralny.
Jest to silny i wysoce żrący kwas mineralny, który jest mieszany z wodą, dzięki czemu można go przygotować w postaci roztworów prawie dowolnego stężenia między 0 a około 18 molowymi.
Wysokie ilości produkcji i zużycia tego związku wynikają z jego wielu zastosowań w branżach tak różnorodnych jak rolnictwo, przemysł petrochemiczny, w syntezie organicznej i nieorganicznej oraz w oczyszczaniu ścieków, aby wymienić tylko niektóre tylko niektóre tylko niektóre niektóre.
Struktura kwasu siarkowego
Kwas siarkowy powstaje przez środkowy atom siarki z Walenciją VI, który jest otoczony 4 atomami tlenu, z których dwa są połączone z atomami wodoru. Jego struktura Lewisa przedstawiono poniżej:
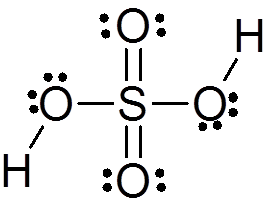
Jak widać, siarka w tym związku jest otoczona 12 elektronów (6 par), więc reprezentuje jeden z wyjątków reguły oktetu.
Otaczana 4 atomami teoria odpychania par elektronów walencji (TREPEV) przewiduje, że ten związek musi przyjąć w przybliżeniu tetraedryczną geometrię, która pokazano na poniższym obrazie:
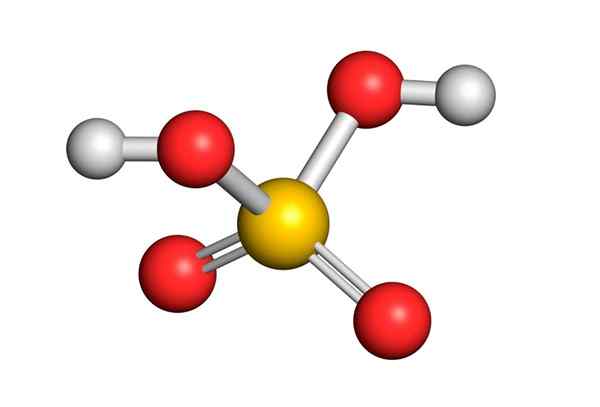
Ze względu na wysoką elektrocjalność tlenu i różne struktury rezonansowe, które może mieć kwas siarkowy, wiązania między tlenem i hydrogenami są silnie spolaryzowane, co czyni je bardzo kwaśnymi i łatwymi do dysocjacji hydrogenów.
Właściwości kwasu siarkowego
W wyniku jego struktury kwas siarkowy ma następujące właściwości fizyczne i chemiczne:
Może ci służyć: epoksyd: nomenklatura, uzyskiwanie, aplikacje, przykładyWłaściwości fizyczne
- Czysty kwas siarkowy to bezbarwny i toaletowy ciecz o gęstości 18302 g/ml.
- Jego temperatura topnienia wynosi 10,31 ° C, a wrzenie wynosi 337 ° C, chociaż w tej temperaturze ma tendencję do rozkładania się w celu wytwarzania wody i bezwodnika siarkowego (zwanego również tritlekiem siarki).
- Jest całkowicie mieszany z wodą, dzięki czemu możesz przygotować roztwory z dowolnym stężeniem. Jednak roztwory z ponad 98,3% masy tego kwasu są niestabilne, a kwas rozkłada się, aż jego stężenie spadnie do 98,3%. Ten roztwór jest stabilny i jest tak zwany stężony kwas siarkowy.
- W stanie czystym lub skoncentrowanym jest to bardziej lepka ciecz niż woda.
Właściwości chemiczne
- Czysty kwas siarkowy jest silnie utleniającą i korozyjną substancją. Ma zdolność utleniania, odwadniania i sulphonaru do szerokiej gamy związków organicznych i karonizowania innych.
- Jest to silny kwas diprotyczny, który całkowicie traci swój pierwszy proton poprzez rozpuszczenie w wodzie, stając się jego skoniugowaną zasadą, jonem Bisulfate (HSO (HSO4-). Ten jon jest również kwasem, choć słabszy niż oryginalny kwas.
- Wodne roztwory kwasu siarkowego są silnie kwaśne i są w stanie rozpuścić wiele metali, wytwarzając wodór gazowy. Są również w stanie całkowicie zneutralizować silne podstawy.
- Reaguje gwałtownie wieloma alkoholi i wodą, uwalniając w tym procesie duże ilości ciepła.
Jak uzyskuje się kwas siarkowy?
Trzy najbardziej znane procesy wytwarzania kwasu siarkowego to: proces kontaktowy, proces mokrego kwasu siarkowego i proces kamer ołowiowych.
1. Synteza kwasu siarkowego w procesie kontaktowym
Jest to najczęściej stosowana metoda do produkcji kwasu siarkowego. Proces składa się z 5 kroków, w których elementarna siarka staje się dwutlenkiem siarki (więc2), a następnie trójtlenek siarki (więc3), kwas disulfurowy (h2S2ALBO7) i wreszcie w kwasie siarkowym. Zaangażowane reakcje to:
Może ci służyć: po co jest romb bezpieczeństwa i do czego służy?
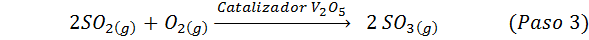


Drugi etap procesu po prostu polega na oczyszczaniu dwutlenku siarki przed przekształceniem w siarkę lub trójokrwadło siarki. Reakcja trzeciego etapu występuje, gdy dwutlenek siarki gazowej wchodzi w kontakt z katalizatorem pentaoksydowym wanadu (v v2ALBO5) I dlatego metoda nazywa się procesem kontaktowym.
2. Synteza kwasu siarkowego według procesu mokrego
Proces ten został zaprojektowany w celu oczyszczania gazów emisji szerokiej gamy branż chemicznych i roślin. Produktem ubocznym tego oczyszczania jest oprócz pary gorącej wody, który można ponownie wykorzystać w pierwotnym procesie przemysłowym, który można ponownie wykorzystać w pierwotnym procesie przemysłowym, który można ponownie wykorzystać w pierwotnym procesie przemysłowym.
W przypadku procesu mokrego reakcje są głównie. Ważne reakcje występujące na każdym etapie to:
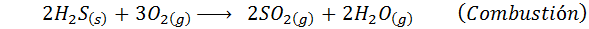
3. Synteza kwasu siarkowego przez proces kamer ołowiowych
Jest to starożytna metoda wytwarzania kwasu siarkowego, który jest dziś używany. Proces polegał na spalaniu elementarnej siarki w obecności tlenu powietrza w drewnianych komorach o ołowiu, a zatem jego nazwę.
Po tym spalaniu dwutlenek siarki reaguje następnie z tlenkami azotu wytwarzanymi przez rozkład azotanu sodu lub w inny sposób. Ostatecznie, po serii dodatkowych reakcji, uzyskano kwas siarkowy.
Może ci służyć: płaskie kolbę tłaTypowe zastosowania
- Główne zastosowanie kwasu siarkowego jest źródłem siarki w postaci siarczanów w produkcji nawozów. W rzeczywistości około 60% kwasu siarkowego wytwarzanego na świecie jest w tym celu przeznaczone.
- W przemyśle chemicznym jest stosowany do syntezy detergentów, pigmentów, katalizatorów dla przemysłu petrochemicznego i w przetwarzaniu minerałów w celu uzyskania różnych metali.
- Wreszcie, kwas siarkowy to elektrolit stosowany w bateriach ołowiowych stosowanych w większości samochodów.
Ryzyko związane z kwasem siarkowym
Ze względu na jego właściwości chemiczne kwas siarkowy może być bardzo niebezpieczny zarówno dla ludzi, jak i zwierząt, a ogólnie środowiska. Są to niektóre ryzyko związane z tą chemiczną:
- Jego żrące i odwodnienie powodują, że czysty kwas powoduje wielkie uszkodzenia, jeśli ma kontakt ze skórą.
- Z drugiej strony reakcja wodnych roztworów kwasu siarkowego z metali generuje wodór gazowy, który jest paliwem i substancją wybuchową.
- Sam kwas siarkowy nie cierpi na reakcję spalania, ale bycie silnym utleniaczem stymuluje spalanie innych substancji, działając jako rodzaj katalizatora, więc stanowi znaczne ryzyko pożaru.
- Ponadto, gdy wystawiono na ogień, można go podzielić na toksyczne gazy i generować opary kwasu siarkowego, które mogą łatwo zniszczyć drogi oddechowe.
Z tych powodów i więcej kwas siarkowy jest substancją, którą należy ostrożnie obsługiwać.