Prawo Henry'ego

- 4942
- 1188
- Pani Waleria Marek
 Prawo Henry'ego wyjaśnia musowanie napojów bezalkoholowych
Prawo Henry'ego wyjaśnia musowanie napojów bezalkoholowych Jakie jest prawo Henry'ego?
Prawo Henry'ego To związek opisuje wpływ ciśnienia na rozpuszczalność gazu. Prawo to określa, że rozpuszczalność gazu w kontakcie z powierzchnią cieczy w danej temperaturze jest wprost proporcjonalna do częściowego ciśnienia wspomnianego gazu na cieczy.
Oznacza to, że im większe ciśnienie gazowe na cieczy, tym większa całkowita ilość gazu, którą można rozpuścić w nim, uzyskując w ten sposób większe stężenie (to znaczy, im większa rozpuszczalność).
Prawo Henry'ego widzimy to w akcji za każdym razem, gdy odkrywamy napój napojowy. Zamknięte, wysokie ciśnienie wewnątrz butelki utrzymuje rozpuszczenie gazu węglowego. Ale odkrywając go, ciśnienie gazowe zmniejsza się, co zmniejsza jego rozpuszczalność i ucieka z tworzenia pęcherzyków i musowania.
Formuła prawa Henry'ego
W formie matematycznej prawo Henry'ego jest wyrażane jako prawo proporcjonalności:
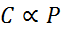
To prawo proporcjonalności przekształca się w:
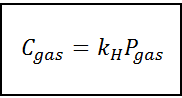
Gdzie C Odnosi się do maksymalnego stężenia gazu w cieczy, to znaczy jego rozpuszczalności; Pgaz Jest to częściowe ciśnienie gazu w kontakcie z cieczą i kH Jest to stała proporcjonalności zwana Prawo Henry'ego stałe.
Stężenie gazu może być wyrażane w różnych jednostkach, takich jak molowość, kret lub frakcja molowa. Jednak w większości przypadków chemikalia stosują stężenie w jednostkach molowościowych (w mol/l), podczas gdy ciśnienie jest wyrażane w atmosferze.
Może ci służyć: antraceen: co to jest, struktura, właściwości, użyciaStała prawa Henry'ego (kH)
Stała kH Opisz interakcje między gazem a rozpuszczalnikiem. Im silniejsze te interakcje są, tym większa stała, a zatem większa rozpuszczalność gazu w rozpuszczalniku w określonej temperaturze i ciśnieniu.
Liczebnie, wartość kH reprezentuje rozpuszczalność gazu w danej temperaturze, gdy ciśnienie częściowe tego samego wynosi 1 atm.
W zależności od jednostek stężenia i ciśnienia zastosowanego w równaniu, ta stała może mieć jednostki molowe/l.ATM, mol/kg.bankomat itp.
Poniższa tabela pokazuje wartości stałej prawa Henry'ego dla niektórych wspólnych gazów w wodzie w temperaturze 25 ° C:

Wartości te zmniejszają się wraz z temperaturą, ponieważ rozpuszczalność gazów ogólnie zmniejsza się w wyższej temperaturze.
Wyjaśnienie prawa Henry'ego
Prawo Henry'ego jest bardzo łatwe do zrozumienia z mikroskopowego punktu widzenia. Możemy sobie wyobrazić gaz jako zestaw bardzo małych cząstek podskakujących na wszystkich powierzchniach, które grają. Kiedy zderzają się z powierzchnią cieczy, niektóre cząsteczki odbijają się, podczas gdy inne przekroczą uwięzienie powierzchni (to znaczy rozpuść się).
To samo dotyczy rozpuszczonych cząstek gazu. Odbijają się ze ścianami pojemnika i mogą również dotrzeć do powierzchni cieczy, gdzie niektórzy odbijają się, podczas gdy inni przekroczą powierzchnię i ucieknie do fazy gazowej.
Po osiągnięciu równowagi prędkości, z którymi gaz rozpuszcza się w rozpuszczalniku i z którym je ucieka, są równe, więc stężenie pozostaje stałe.
Może ci służyć: właściwości mechaniczne metali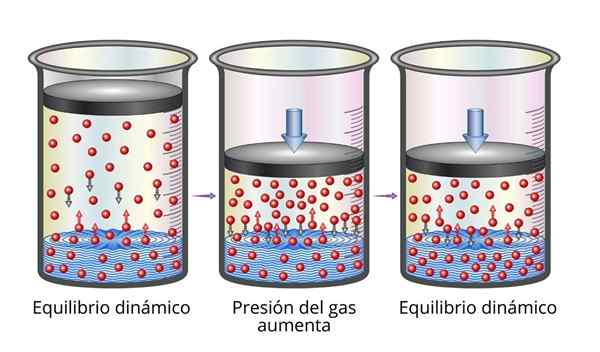 Wyjaśnienie prawa Henry'ego
Wyjaśnienie prawa Henry'ego Kiedy zwiększamy ciśnienie gazowe, robimy to, aby zwiększyć częstotliwość, z jaką cząstki gazu zderzają się z powierzchnią cieczy. To sprawia, że prędkość rozpuszcza się prędkość, z jaką gaz gaz. Po osiągnięciu nowej równowagi nowe stężenie gazu będzie większe.
Wyjątki od prawa Henry'ego
Ważne jest, aby podkreślić, że prawo Henry'ego jest prawem idealnym, które opisuje jedynie zachowanie prawdziwych rozwiązań gazowych w określonych warunkach. Zatem prawo Henry'ego można zastosować tylko wtedy, gdy:
- Temperatura pozostaje stała.
- Gaz jest w równowadze z rozwiązaniem.
- Ciśnienie gazowe jest stosunkowo niskie.
- Gaz nie reaguje z rozpuszczalnikiem.
Mimo to, nawet w niektórych przypadkach, w których gaz reaguje z rozpuszczalnikiem, prawo to można zastosować w przybliżeniu.
Przykłady zastosowania prawa Henry'ego
Przykład 1: Określenie stałej prawa Henry'ego
Eksperymentalnie ustalono, że stężenie wodnego roztworu w równowadze z neonem pod ciśnieniem 3,00 atm i 25 ° C wynosi 0,00135 mol/l. Określ stałą prawa Henry'ego dla neonu w wodzie w temperaturze 25 ° C.
Rozwiązanie:
Zgodnie z prawem Henry'ego:
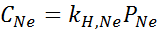
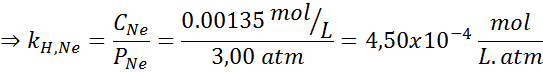
Dlatego stała prawa Henry'ego dla neonu w wodzie w temperaturze 25 ° C wynosi 4,50 × 10-4 Mol/L.bankomat.
Przykład 2: Określenie rozpuszczalności gazu
Korzystając z stałej prawa Henry'ego podanego w poprzednim tabeli, określ rozpuszczalność dwutlenku węgla powietrza w wodzie na poziomie morza, wiedząc, że ułamek molowy wspomnianego gazu w powietrzu wynosi 3,14 × 10-4.
Rozwiązanie:
Na poziomie morza ciśnienie powietrza wynosi 1 atm, a częściowe ciśnienie CO2 Jest podany przez:
Może ci służyć: hipoodous kwas (Hio)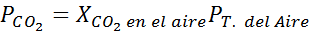
Zastępowanie tego wyrażenia w prawie Henry'ego:
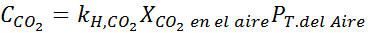
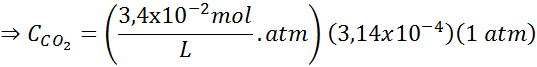
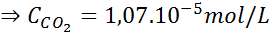
Przykład 3: Gazy nurkowe
Gdy nurka nic na głębokości większej niż 30 metrów, mieszanka powietrza musi oddychać innymi gazami obojętnymi, takimi jak hel lub argon, ponieważ wzrost stężenia azotu w przewidywanej krwi przez prawo Henry'ego ma działanie narkotyczne, które powodują dezorientację, zamieszanie i wzrok problemy.
Efekt ten zaczyna obserwować, gdy oddycha powietrze (xN2= 0,78) pod ciśnieniem 4,00 atm. Jeśli nurka planuje zejść do głębokości do 100 metrów, gdzie ciśnienie wynosi około 11,0 atm, jaka jest maksymalna frakcja azotu, która może oddychać, zanim cierpi na handlarzy narkotyków?
Rozwiązanie:
Na podstawie stwierdzenia możemy wywnioskować, że maksymalne stężenie azotu występuje, gdy ciśnienie powietrza wynosi 4,00 atm. Zgodnie z prawem Henry'ego i stosowanie związku między całkowitą ciśnieniem a częściowym ciśnieniem poprzedniego przykładu:
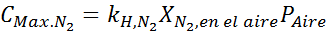
To musi być to samo maksymalne stężenie przy każdym ciśnieniu całkowitym. Tak więc 100 metrów:
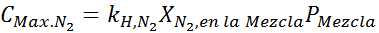
Wyrównując oba równania, możemy znaleźć maksymalną frakcję molową azotu w mieszaninie:
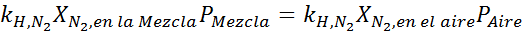
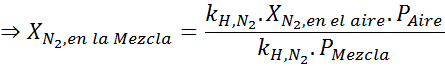
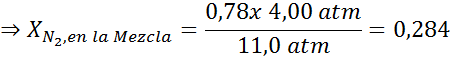
Oznacza to, że nurek nie powinien używać mieszaniny zawierającej więcej niż 28,4% azotu, jeśli planuje nurkować do głębokości do 100 metrów.

