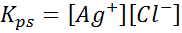Prawo masowe

- 3524
- 396
- Arkady Sawicki
 Reakcja opadów obejmuje równowagę rozpuszczalności, którą rządzi prawo masowego działania
Reakcja opadów obejmuje równowagę rozpuszczalności, którą rządzi prawo masowego działania Jakie jest prawo masowego?
Prawo masowe stwierdza, że prędkość reakcji zależy od stężenia jej reagentów podniesionych do jego współczynników stechiometrycznych. Prawo to pozwala odnosić się do siebie stężenia w równowadze reagentów i produktów odwracalnej reakcji chemicznej. Innymi słowy, ustala wzór stałej równowagi.
Prawo masowego działania zostało wydane przez chemików norweskich (i kremowych) Cato M. Guldberg (1836–1902) i Peter Waage (1833–1900) w 1864 r. Jest to jedno z podstawowych praw chemii, ponieważ pozwala nam obliczyć końcowe stężenia w równowadze od początkowych.
Oprócz tego prawo masowe pozwala nam również łatwo zrozumieć wpływ zmian w stężeniach dowolnego gatunku na równowagę. Innymi słowy, pozwala nam zrozumieć, jak działają zasady Le Chatliera.
Pomimo nazwy „prawem masowym”, tak naprawdę nie odnosi się to do mas reagentów i produktów, ale raczej do ich stężeń. Powodem, który nazywa się prawem masowym, a nie prawo działania stężeń jest to, że stężenie nazywane było „masą aktywną”.
Prawo do działania masowego i stała równowagi
Zgodnie z ustawą o masowym działaniach, gdy odwracalne reakcje osiągają równowagę, nie dlatego, że reakcja zatrzymuje się. Przeciwnie, równowaga jest osiągana, gdy prędkość bezpośredniej reakcji jest wykonywana równa prędkości reakcji odwrotnej. Kiedy tak się dzieje, wszystkie gatunki chemiczne występują i spożywane z tą samą prędkością, więc ich stężenia stają się stałe (przestają się zmieniać).
Może ci służyć: tolueen: struktura, właściwości, użycia, uzyskiwanieGuldberg i Waage odkryli, że prędkości obu reakcji (bezpośrednie i odwrotne) zależą od stężenia molowego (w mol/l) od odczynników podwyższonych do współczynników stechiometrycznych. Z tych obserwacji udało im się znaleźć wzór dla stałej równowagi.
Zgodnie z tym prawem, dla każdej odwracalnej reakcji chemicznej, która osiąga równowagę,
„… Związek między produktem stężeń molowych produktów podniesionych do ich współczynników stechiometrycznych a produktem stężeń molowych reagentów podniesionych na ich współczynniki stechiometryczne jest stałe w pewnej temperaturze."
Ta stała nazywa się „stałą równowagi” i jest reprezentowana z symbolem kC.
Równowaga stała wzór
Zobaczmy, jak wygląda poprzednie stwierdzenie w postaci równania matematycznego. Jest to odwracalna reakcja chemiczna, taka jak ta przedstawiona poniżej, gdzie A i B są reagentami, C i D Produkty, a A, B, C i D są odpowiednimi stechiometrycznymi współczynnikami reakcji zrównoważonej:
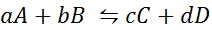
Dla takiej reakcji ogólnej stała równowagi jest podana przez:
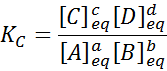
gdzie [a], [b], [c] i [d] są stężeniami molowymi A, B, C i D w równowadze.
Stała bilansu pod presją
Poprzedni wzór dla stałej równowagi dotyczy każdej reakcji chemicznej, w której wszystkie substancje znajdują się w tej samej fazie (to znaczy, że wszystkie są w fazie wodnej lub na przykład w fazie gazowej). Jednak w przypadku reakcji fazy gazowej wygodniej jest pracować z ciśnieniami niż ze stężeniami.
Ponieważ stężenie molowe gazów jest proporcjonalne do ich ciśnienia częściowego, wówczas wzór stałej równowagi można przepisać pod względem tych ciśnienia, jak następuje:
Może ci służyć: 30 zastosowań kwasów karboksylowych w życiu codziennym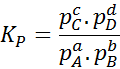
Gdzie pDO, PB, PC I pD Są to częściowe ciśnienie odpowiednio A, B, C i D, a A, B, C i D pozostają współczynnikami stechiometrycznymi. W tym przypadku kP Nazywa się to stałą równowagą na presji i jest związany z kC Poprzez następujący formułę:
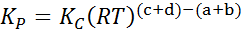
gdzie r jest uniwersalną stałą gazów idealnych, a t jest temperaturą bezwzględną w Kelvin.
Reakcje obejmujące więcej niż jedną fazę
Czasami reakcja chemiczna obejmuje tworzenie stałego jako osad z roztworu lub tworzenie cieczy z reagentów, które reagują w fazie gazowej. W takich przypadkach reakcja nie dzieje się w tej samej fazie, więc musimy zmodyfikować wzór stałego równowagi.
Na szczęście modyfikacje są bardzo proste. Jedyną rzeczą, którą musimy wziąć pod uwagę przy pisaniu wzoru stałej równowagi, jest to, że czyste substancje, które pojawiają się jako ciśnienie stałych lub cieczy. W razie potrzeby zamiast tego umieszczamy 1.
Podsumowując, prawo działań masowych pozwala napisać formułę stałej równowagi zarówno w stężeniach, jak i na ciśnieniach częściowych. Po znaczeniu jednego z nich, drugiego można znaleźć od pierwszego.
Wreszcie, musimy być ostrożni i przejrzeć fazę, w której znajdują się wszystkie gatunki chemiczne, aby wiedzieć, czy musimy je uwzględnić w stałej równowagi.
Przykłady użycia prawa masowego
W poniższych przykładach pokazujemy, jak użyć prawa działania masowego do napisania wzorów stałych równowagi dla różnych rodzajów reakcji chemicznych.
Reakcje reakcji w stanie gazowym
Przykład 1: Rozkład n2ALBO4 w fazie gazowej
Następnie2ALBO4 Jest to brązowy gaz, który rozkłada się zgodnie z następującą reakcją:
Może ci służyć: kwas láurowy: struktura, właściwości, zastosowania, korzyści, skutki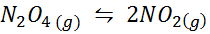
 Próbka NO2 w różnych temperaturach pokazująca przemieszczenie równowagi do brązowego N2O4
Próbka NO2 w różnych temperaturach pokazująca przemieszczenie równowagi do brązowego N2O4 W przypadku tej reakcji stałe równowagi w stężeniach i ciśnieniach podaje:
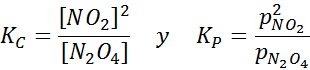
Przykład 2: Utlenianie tlenku węgla
Tlenek węgla jest bardzo toksycznym gazem, który może stać się dwutlenkiem węgla podczas reakcji z tlenem zgodnie z następującą reakcją:
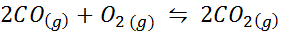
W przypadku tej reakcji stałe równowagi w stężeniach i ciśnieniach podaje:
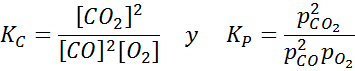
Równowagi kwasowe w fazie wodnej
Przykład 3: Woda sama -długość
Bilans jonowy wody, znany również jako reakcja na siebie, jest odwracalną reakcją między dwoma cząsteczkami wody w stanie ciekłym. Reakcja to:
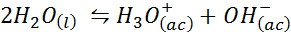
Pisząc stałą równowagi dla tej reakcji, musimy wziąć pod uwagę, że w tym przypadku jedynym odczynnikiem jest czysta ciecz, którego stężenie jest praktycznie stałe. Z tego powodu nie jest on uwzględniony w wzorze stałej równowagi:
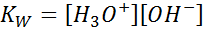
Jest to bardzo ważna stała równowagi, która otrzymuje własną nazwę (stała jonowego produktu wody) i własny symbol (kW. W odnosi się do wody w języku angielskim, co mówi się toaleta). Jest to jednak stała równowagi w stężeniach, jak każde inne.
Równowaga rozpuszczalności
Przykład 4: Równowaga rozpuszczalności chlorków srebra
Kiedy przygotowujemy nasycone rozwiązanie, ustalono równowagę rozpuszczalności. W takim przypadku równowaga jest realizacja rozpuszczania chlorku srebra, którego reakcja jest dana przez:
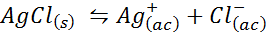
Stała równowagi tej reakcji (i wszystkich reakcji roztworu) nie obejmuje chlorku srebra (AGCL), ponieważ jest to stałe. Ponadto, podobnie jak w przypadku wody, stałe te otrzymują również specjalną nazwę, która jest „stała produktu rozpuszczalności”, reprezentowana jako k$: