Isóbaros
- 2380
- 214
- Gabriela Łuczak
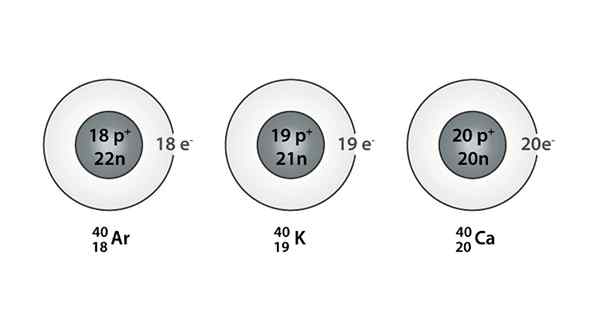
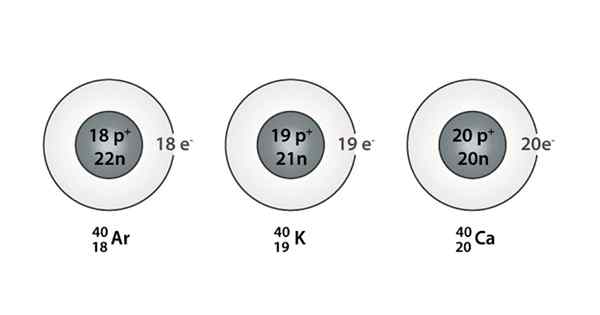 Przykład Isóbaro; Argon, potas i wapń, które mają atomy tej samej masy (40)
Przykład Isóbaro; Argon, potas i wapń, które mają atomy tej samej masy (40) Jakie są izoparos?
Isóbaros Są to gatunki atomowe, które mają tę samą masę, ale pochodzą z różnych elementów chemicznych. W wyniku tego można powiedzieć, że są one składane przez różną liczbę protonów i neutronów.
Zarówno protony, jak i neutrony znajdują się w jądrze ich atomów, ale ilość netto neutronów i protonów obecnych w każdym jądrze pozostaje taka sama. Innymi słowy, gatunek Isóbara pochodzi, gdy para jąder atomowych pokazuje tę samą liczbę netto neutronów i protonów dla każdego gatunku.
Jednak liczba neutronów i protonów, które stanowią, że kwota netto jest inna. Jednym ze sposobów zauważenia, że jest to obserwowanie numeru masy (umieszczonej na lewej górnej stronie symbolu reprezentowanego elementu chemicznego), ponieważ w izopach ta liczba ta jest taka sama jest taka sama, jest taka sama.
Etymologia terminu Isóbaro pochodzi od greckich słów ISOS (co oznacza „to samo”) i Baros (co oznacza „wagę”), co odnosi się do równości ciężarów między obiema gatunkami nuklearnymi.
Charakterystyka izoparos
- Isoparos zachowują pewne podobieństwa z innymi gatunkami, których jądra występują zbieg okoliczności, takich jak izotoniorzy, które mają taką samą ilość neutronów, ale z różną liczbą masy i liczby atomowej, takich jak rówieśnicy 13C i 14NIE 36S i 37Cl.
- Termin „nukleid” jest nominacją, która została wymyślona do każdego z zestawów nuklei (struktury utworzone przez neutrony i protony), które można uformować. Tak, aby jądra prawdopodobnie odróżniają się przez liczbę neutronów lub protonów, a nawet za ilość energii, jaką ma struktura jego konglomeracji.
Może ci służyć: upłynnienie: koncepcja, gazy, gleby i sejsmiczne, przełomowe- Podobnie, po β pojawia się jądro dziecięce, a ten proces z kolei jest to izopar jądra ojca, ponieważ liczba nukleonów obecnych w jądrze pozostaje niezmieniona, w przeciwieństwie do tego, co dzieje się za pomocą rozpadu α α.
- Ważne jest, aby pamiętać, że różne Isóbaros mają różną liczbę atomową, potwierdzając, że są to różne elementy chemiczne.
Reprezentacja
Aby oznaczyć różne nukleidy, stosuje się określoną notację, którą można reprezentować na dwa sposoby: jeden polega na umieszczeniu nazwy elementu chemicznego, a następnie ich numeru masowego, zjednoczonego skryptem. Na przykład: azot-14, którego jądro składa się z siedmiu neutronów i siedmiu protonów.
Innym sposobem reprezentowania tych gatunków jest umieszczenie symbolu elementu chemicznego, poprzedzonego numerycznym przesądem, który wskazuje liczbę masy, którą posiada dany atom, a także liczbowa indeks inlny, który wyznacza jego liczbę atomową, następujący sposób :
ZDOX
W tym wyrażeniu x reprezentuje element chemiczny danego atomu, a jest liczbą masy (wynik dodania między ilością neutronów i protonów), a Z reprezentuje liczbę atomową (równa ilości protonów w jądrze jądra atom).
Gdy te jądra są reprezentowane, liczba atomowa atomu (z) jest zwykle pomijana, ponieważ nie daje odpowiednich dodatkowych danych, więc jest to często reprezentowane jako DOX.
Jednym ze sposobów pokazania tej notacji jest przyjęcie poprzedniego przykładu (azot-14), który jest również oznaczony jako 14N. To jest notacja używana dla izoboos.
Może ci służyć: rozległe właściwości materiiPrzykłady Isóbaros
Zastosowanie wyrażenia „isóbaros” dla gatunków znanych jako nukleidy, które mają taką samą liczbę jąder (równa liczba masy) zostało zaproponowane pod koniec lat 1910 przez chemik brytyjskiego pochodzenia Alfred Walter Stewart.
W tej kolejności pomysłów można zaobserwować przykład izoboos w przypadku gatunku 14C i 14N: Numer masowy jest równy 14, oznacza to, że liczba protonów i neutronów u obu gatunków jest inna.
Rzeczywiście, ten atom węgla ma liczbę atomową równą 6, więc w swojej strukturze jest 6 protonów, a z kolei ma 8 neutronów w jądrze. Wtedy twój numer masowy wynosi 14 (6+8 = 14).
Ze swojej strony atom azotu ma liczbę atomową równą 7, więc składa się z 7 protonów, ale ma 7 neutronów w jądrze. Twój numer masowy wynosi również 14 (7+7 = 14).
Możesz także znaleźć serię, w której wszystkie atomy mają numer masowy równy 40; Tak jest w przypadku Isóbaros: 40AC, 40K, 40Ar, 40Cl i 40S.
Różnice między izoto i izotopami
Nurydy opisują różne rodzaje jąder atomowych, które istnieją, zgodnie z ilością posiadanych protonów i neutronów.
Podobnie między tego typu nukleidy są izotropos i izotopy, które zostaną zróżnicowane poniżej.
W przypadku Isóbaros, jak wspomniano wcześniej, mają one taką samą liczbę nukleonów -to znaczy ten sam numer masowy -gdzie liczba protonów, według których jeden gatunek jest wyższy niż drugi zgadza się z liczbą neutronów, które są w deficyt, więc suma jest taka sama. Jednak twoja liczba atomowa jest inna.
Może ci służyć: Rozwiązania krystaloidowe: skład, typy i przykładyW tym sensie gatunki izopowe pochodzą z różnych pierwiastków chemicznych, więc znajdują się w różnych przestrzeniach stolika okresowej i mają różne cechy i właściwości określone.
Z drugiej strony w przypadku izotopów dzieje się odwrotnie, ponieważ mają one tę samą liczbę atomową, ale inną masę; Oznacza to, że mają taką samą liczbę protonów, ale różną liczbę neutronów w ich jądrach atomowych.
Ponadto izotopy są gatunkami atomowymi należącymi do tych samych elementów, więc znajdują się w tej samej przestrzeni w tabeli okresowej i mają podobne cechy i właściwości.

